Solidi ionici
Struttura dei solidi ionici
Un corpo allo stato solido è un materiale che ha forma propria, è incomprimibile, rigido e presenta un proprio volume.
Le particelle che costituiscono il reticolo cristallino di un solido sono animate da un moto oscillatorio (e può esistere anche un moto rotatorio) attorno ad un punto (nodo reticolare) che viene assunto come rappresentativo della posizione (media) della particella nel reticolo cristallino.
In un solido ionico i nodi reticolari sono occupati da ioni mantenuti nelle loro posizioni di equilibrio da forze coulombiane, attrattive e repulsive.
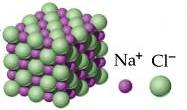
Reticolo cristallino del cloruro di sodio Na+Cl−
La formula chimica di un solido ionico (esempio NaCl per il cloruro di sodio) non descrive una struttura molecolare, ma è una rappresentazione di comodo, che indica la proporzione esistente nel cristallo tra ioni cationi e anioni (formula minima).
Nel caso del cloruro di sodio NaCl tale proporzione è di 1:1.
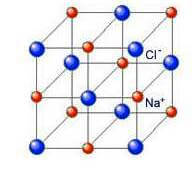
Ricordiamo anche che il sistema costituito da ioni separati (negativi e positivi) ha un contenuto energetico maggiore di quello del sistema costituito dagli stessi ioni uniti a formare un reticolo cristallino; questa differenza di energia rappresenta l'energia reticolare, che è dell'ordine delle centinaia fino al migliaio di kJ/mol.
I solidi ionici hanno perciò temperature di fusione abbastanza elevate e sono (con poche eccezioni) cattivi conduttori dell'elettricità (infatti gli ioni che costituiscono il reticolo non sono mobili).
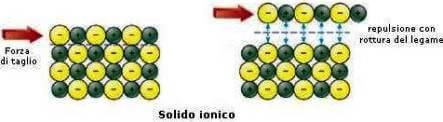
I solidi ionici sono inoltre fragili; la loro fragilità è dovuta alla presenza in essi delle cariche positive e negative.
Una sollecitazione meccanica provoca lo scorrimento dei piani, perciò le cariche uguali vengono a contatto.
La notevole repulsione provoca la frattura.
Cristalli ionici perfetti sono rari perché per lo più presentano difetti reticolari. NaCl, ad esempio, a seconda del metodo di preparazione può contenere ioni Na+ neutralizzati non da ioni Cl− ma da elettroni (in questo caso il cristallo è lievemente colorato in giallo e presenta proprietà di semiconduttore).
Link correlati:
Come possono essere classificati i solidi in base al tipo di legame chimico?
Studia con noi