Interazione dipolo-dipolo
Generalità e proprietà dell'interazione dipolo-dipolo
Le molecole dipolari (molecole con due poli, uno positivo δ+ e l'altro negativo δ− e quindi dotate di un momento di dipolo µ) creano attorno a sé deboli campi elettrici che fanno sentire la propria attrazione su altre molecole polari vicine.
In questo modo si verifica un'attrazione elettrostatica tra i poli opposti di due molecole: tale interazione è detta interazione dipolo-dipolo o interazione di Keesom.
Le molecole dipolari si avvicinano e tendono a disporre i loro poli di carica opposta l'uno di fronte all'altro.
In tale modo si raggiunge una configurazione di elevata stabilità che rende minima l'energia potenziale del sistema:

Le interazioni dipolo-dipolo non sono molto efficienti nello stato gassoso poiché le distanze intermolecolari sono troppo elevate.
All'abbassarsi della temperatura e/o all'aumentare della pressione succede però che le distanze intermolecolari diminuiscono e le interazioni dipolo-dipolo conseguentemente aumentano.
L'energia cinetica media delle molecole diventa inferiore alle interazioni dipolari.
Queste ultime sono in grado a questo punto di mantenere coese le molecole e si ha pertanto il passaggio allo stato liquido.
Se la temperatura scende ulteriormente e/o la pressione aumenta, le interazioni dipolo-dipolo crescono ulteriormente e si viene a formare lo stato solido.
L'intensità delle interazioni dipolo-dipolo dipende ovviamente dal valore del momento di dipolo µ. Per valori di µ superiori a 1 D, queste interazioni iniziano a diventare importanti.
L'intensità di queste interazioni decresce inoltre all'aumentare della temperatura; un aumento di temperatura infatti comporta una maggior agitazione termica delle molecole che interferisce e disturba l'allineamento dei dipoli.
Come si calcola l'intensità dell'interazione dipolo-dipolo
Per due dipoli liberi di ruotare (e quindi appartenenti a una sostanza liquida o aeriforme) posti a una distanza r e di momento µ1 e µ2, l'intensità dell'interazione dipolo-dipolo è:
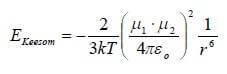
in cui:
- r = distanza tra i dipoli (m)
- k = costante di Boltzmann = 1,38 · 10-23 (J · K-1)
- εo = costante dielettrica del vuoto = 8,854 · 10-12 (C2 · m-2 · N-1)
- µ1 e µ2 = momenti di dipolo delle due molecole (C · m)
- T = temperatura assoluta (K)
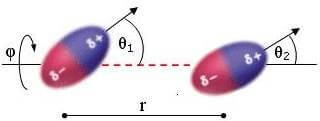
Per due dipoli stazionari (e quindi appartenenti a una sostanza solida) posti a una distanza r, di momento µ1 e µ2 e di orientazione reciproca θ1, θ2 e φ, l'intensità dell'interazione dipolo-dipolo è:
![]()
Una interazione dipolo-dipolo particolarmente intensa è quella nota con il nome di legame a idrogeno o ponte a idrogeno.
Studia con noi