Struttura del diamante
Qual è la struttura del diamante?
L'atomo di carbonio esiste in tre forme allotropiche: diamante, grafite e fullerene.
Tra diamante e grafite, la forma termodinamicamente stabile è la grafite (ΔG°f,grafite = 0,00 kJ/mol ; ΔG°f,diamante = 2,9 kJ/mol).
Il diamante, per la lentezza della trasformazione diamante → grafite, termodinamicamente spontanea, è cineticamente stabile.
Nel diamante ciascun atomo di carbonio è ibridizzato sp3.
I quattro orbitali ibridi sp3 puntano verso i vertici di un tetraedro, disponendosi a 109,5° l'uno dall'altro:
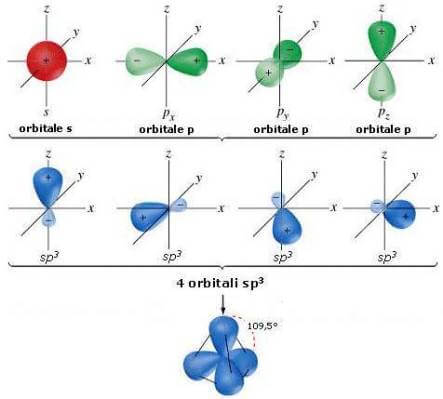
Ciascun atomo di carbonio è legato covalentemente (mediante i quattro orbitali ibridizzati sp3) ad altri quattro atomi C.
Ogni diamante è quindi una molecola unica (solido covalente) costituita da un enorme numero di atomi C distanti 0,154 nm l'uno dall'altro.
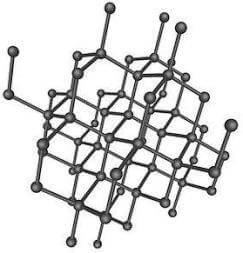
Struttura del diamante
Proprietà fisiche e chimiche
Riassunte di seguito le principali proprietà fisiche e chimiche del diamante:
- gli elettroni del diamante sono tutti impegnati nei legami covalenti e pertanto il diamante è un isolante elettrico;
- se contiene impurezze il diamante può manifestare proprietà di semiconduttore;
- l'elevato valore dell'indice di rifrazione impartisce al diamante la caratteristica proprietà di decomporre la luce bianca nei suoi colori costitutivi;
- il diamante ha una eccezionale conducibilità termica dovuta alle vibrazioni delle particelle;
- il suono si trasmette nel diamante con elevata velocità;
- riscaldato all'aria il diamante brucia a circa 850 °C;
- riscaldato nel vuoto, il diamante a circa 1500°C inizia a trasformarsi in grafite.
Link correlati:
Che cos'è il diamante sintetico?
Che cos'è l'ibridazione sp3 del carbonio?
Studia con noi