Elettroforesi
Principio di funzionamento dell'elettroforesi
L'elettroforesi è un fenomeno elettrocinetico per cui particelle colloidali o ioni macromolecolari dotati di carica elettrica si muovono sotto l'influenza di un campo elettrico, spostandosi verso il catodo se sono dotate di carica positiva e verso l'anodo se hanno invece carica negativa.
La differenza tra la velocità di migrazione delle varie particelle dipende dalle loro cariche e dimensioni e fornisce un metodo utile per l'analisi e la separazione di sostanze altrimenti difficilmente frazionabili.
Si definisce mobilità elettroforetica la velocità di migrazione in un campo elettrico a gradiente unitario (1V/cm).
Elettroforesi in fase libera
Nell'elettroforesi in fase libera o elettroforesi delle frontiere mobili, ormai sostituita da metodi più moderni, la soluzione colloidale da esaminare viene disposta in un tubo a U, al di sotto di una soluzione tampone.
Applicando un campo elettrico esterno, tutte le particelle che hanno la stessa mobilità si muovono insieme spostandosi verso uno degli elettrodi della superficie di separazione tra la soluzione colloidale e la soluzione tampone (tale superficie è detta, appunto, frontiera).
Si avranno tante frontiere quante sono le specie in soluzione dotate della stessa mobilità.
Questo metodo è stato soppiantato dalla elettroforesi in fase stabilizzata.
Elettroforesi in fase stabilizzata
Nella elettroforesi in fase stabilizzata, la migrazione avviene o su un supporto solido, come per esempio carta da filtro o membrana di acetato di cellulosa imbevute di soluzione tampone, oppure in un mezzo costituito da gel d'agar o gel d'amido.
In questo caso le frontiere sono molto più stabili e le apparecchiature da usare molto più semplici che nel caso precedente.
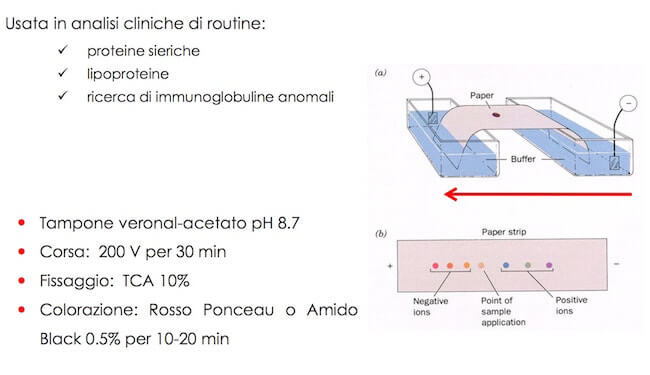
Elettroforesi su acetato di cellulosa
Altri tipi di elettroforesi
In biochimica, dove l'elettroforesi è largamente usata, l'impiego di materiali di supporto innovativi (gel di agarosio o di poliacrilammide) ha permesso di introdurre nuove tecniche elettroforetiche come la isotacoforesi, che utilizza forza ionica e pH differenti nel gel di supporto, o la isoelettrofocalizzazione che, mediante aggiunta di composti di varia natura acida o basica (anfoliti), consente di separare proteine con differenze di punto isoelettrico di 0,01 unità di pH.
Altre tecniche messe a punto sono la PGFE (Pulse Field Gel Electrophoresis), che rende possibile separare frammenti di DNA della lunghezza di poche migliaia di basi, e la elettroforesi capillare che, utilizzando capillari del diametro interno tra 50 e 300 nm e della lunghezza di 50-100 cm e un voltaggio applicato di 10-50 kV, permette l'analisi di molecole biologiche contenute in 0,005-0,30 µl di campione.
L'elettroforesi capillare è una tecnica di analisi molto versatile che permette l'analisi di una vasta gamma di biomolecole come ad esempio proteine, peptidi, aminoacidi e acidi nucleici.
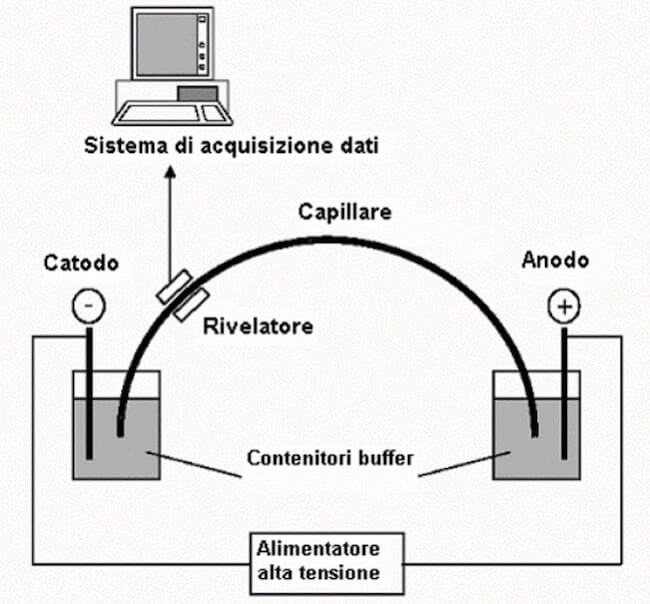
Nell'elettroforesi capillare il campione da analizzare viene iniettato all'interno del capillare.
Applicazioni
Applicazioni importanti dell'elettroforesi si hanno in campo biologico, nella separazione e nell'analisi di proteine (in particolare delle proteine del siero del sangue), dei polisaccaridi e degli acidi nucleici.
Nel caso delle proteine la carica netta, presente a un dato valore di pH, determina la direzione e la velocità del suo movimento in seguito a elettroforesi in campo elettrico.
Se l'elettroforesi si conduce in presenza del detergente anionico sodio dodecilsolfato (SDS) si può stimare il peso molecolare di proteine e subunità proteiche dopo rottura di ponti disolfuro.
Questo metodo di separazione delle proteine è spesso indicato come SDS-page.
Link correlati:
Che cos'è l'elettrodialisi?
Studia con noi