Nitrato di ammonio
Proprietà e caratteristiche del nitrato di ammonio
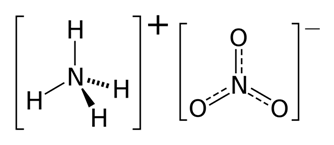
Il nitrato di ammonio è un sale con formula chimica NH4NO3.
Fu preparato e descritto nel 1659 da Glauber, che lo chiamò "nitrum flammans" per il colore giallo della sua fiamma.
Proprietà fisiche del nitrato di ammonio
Una caratteristica importante del nitrato di ammonio, anche per i riflessi pratici, è quella del polimorfismo : il nitrato di ammonio presenta infatti cinque modificazioni cristalline (per pressioni fino a 9000 bar):
I - Sistema cubico - Campo di stabilità: da 125,2°C a 169,6°C
II - Sistema tetragonale - Campo di stabilità: da 84,2°C a 125,2°C
III - Sistema α-rombico - Campo di stabilità: da 32,3°C a 84,2°C
IV - Sistema β-rombico - Campo di stabilità: da -18°C a 32,3°C
V - Sistema tetragonale - Campo di stabilità: < -18°C
La transizione di fase è accompagnata da variazione del volume specifico, che è massima (3,6%) per la trasformazione IV→III.
Questo comporta l'instaurarsi di tensioni intercristalline sia durante il processo di fabbricazione (nel quale la temperatura scende da circa 180°C a quella ambiente), sia nel corso della giacenza in magazzino dove possono aversi variazioni di temperatura che interessano la transizione a 32,3 °C.
Come conseguenza si ha la rottura dei granuli e quindi l'aumento della superficie specifica della massa di sale in equilibrio con l'ambiente atmosferico. Questo comporta un aumento degli scambi con l'umidità dell'aria, che possono portare all'impaccamento del sale per ricristallizzazione.
L'alta igroscopicita del nitrato ammonico è dovuta alla sua forte solubilità in acqua ed al conseguente abbassamento della tensione di vapore dalle sue soluzioni sature. A 0°C queste contengono il 54,9% di sale ed a 100°C il 91,1%.
Il nitrato di ammonio è anche molto solubile in ammoniaca anidra o acquosa, e questa circostanza è utilizzata per la produzione di fertilizzanti liquidi a base di nitrato ammonico ed ammoniaca.
Proprietà chimiche del nitrato di ammonio
Il comportamento chimico del nitrato di ammonio è principalmente in relazione alle sue energiche proprietà ossidanti, per cui esso reagisce facilmente con molte sostanze organiche, specie a temperature superiori all'ambiente, e, allo stato fuso, scioglie numerosi metalli ed ossidi metallici, spesso con decorso esplosivo.

Sottoposto a riscaldamento, il nitrato di ammonio si decompone secondo la reazione:
NH4NO3 → N20 + 2 H2O
Questa reazione avviene al di sopra del punto di fusione, ed è sufficientemente controllabile fino a 260 °C; oltre questa temperatura, oppure in seguito ad un aumento della pressione, la decomposizione può diventare esplosiva, assumendo la forma:
4 NH4NO3 → 2 NH3 + 3 NO2 + NO + N2 + 5 H2O
Queste caratteristiche del nitrato ammonio obbligano ad adottare determinanti criteri di sicurezza durante la lavorazione, la giacenza in magazzino ed il trasporto.
In linea generale i concetti seguiti sono quelli di minimizzare i tempi di soggiorno negli apparecchi che lavorano alle più alte temperature, di impiegare acido nitrico esente da ossidi superiori d'azoto disciolti (che darebbero luogo a nitrito ammonico facilmente decomponibile) e di evitare il contatto con fonti di calore e con sostanze estranee (specie organiche) durante lo stoccaggio e il trasporto.
Reazioni caratteristiche del nitrato di ammonio
Il nitrato di ammonio reagisce con gli idrossidi dei metalli alcalini sviluppando ammoniaca e i nitrati del metallo alcalino. La reazione è la seguente:
NH4NO3 + NaOH → NH3 + H2O + NaNO3
Il nitrato di ammonio reagisce con HCl formando cloruro di ammonio ed acido nitrico:
NH4NO3 + HCl → NH4Cl + HNO3
Ad alte temperature (> 210°C) il nitrato di ammonio decompone secondo la seguente reazione:
NH4NO3 → N2O + 2H2O
pH di una soluzione di nitrato di ammonio
NH4NO3 disciolto in acqua si dissocia nei suoi due ioni:
NH4NO3 → NH4+ + NO3−
Mentre lo ione NO3− non dà idrolisi, lo ione NH4+ dà idrolisi acida:
NH4+ + H2O → NH3 + H3O+
Pertanto il pH di una soluzione acquosa di NH4NO3 è acido.
Produzione del nitrato di ammonio
La produzione industriale del nitrato di ammonio si basa essenzialmente nella reazione di neutralizzazione tra ammoniaca ed acido nitrico:
NH3(g) + HNO3(g) → NH4NO3(s)
Impieghi
Gli usi più importanti del nitrato di ammonio riguardano il campo degli esplosivi e dei fertilizzanti; questi ultimi riguardano circa il 93% dei consumi totali.
A causa del processo fortemente endotermico che si ha nella solubilizzazione in acqua di questo sale, il nitrato di ammonio viene utilizzato nella produzione del ghiaccio istantaneo.
Struttura del nitrato di ammonio, NH4NO3
Ioni equivalenti: NH4+ , NO3−
Link correlati:
Qual è la differenza tra deflagrazione e detonazione
Studia con noi