Acido silicico (acido ortosilicico)
Proprietà e caratteristiche dell'acido silicico
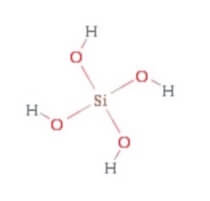
L'acido silicico (o acido ortosilicico o acido monosilicico) è un acido tossico ed aggressivo con formula chimica H4SiO4.
Presenta la seguente struttura:
Viene prodotto per reazione del biossido di silicio con acqua, secondo la seguente reazione chimica:
SiO2 + 2 H2O → H4SiO4
La reazione è analoga a quella che l'anidride carbonica dà con l'acqua:
CO2 + H2O → H2CO3
SiO2 (detto anche con nome tradizionale anidride silicica), è infatti come CO2, un ossido a carattere acido.
L'acido saliciclico (Ka = 10-10) è un acido più debole dell'acido carbonico in accordo con il fatto che il silicio ha proprietà metalliche superiori a quelle del carbonio.
Soluzioni acquose di acido silicico monomero possono aversi solo a pH = 2-3.
I sali dell'acido silicico sono chiamati silicati oppure ortosilicati.
Preparazione dell'acido silicico
Sospendendo in acqua la silice amorfa si realizza un equilibrio di idratazione con formazione di una soluzione satura di acido ortosilicico H4SiO4:
SiO2(solido) + 2H2O ⇄ H4SiO4(soluz.)
È una massa bianca gelatinosa, insolubile nell'acqua e nei comuni acidi minerali, solubile invece nell'acido fluoridrico per dare il tetrafluoruro di silicio:
H4SiO4 + 4 HF → 4 H2O + SiF4
e negli idrati alcalini per dare i silicati alcalini, detti vetri solubili:
H4SiO4 + 4 NaOH → Na4SiO4 + 4 H2O
L'acido ortosilicico è un acido molto debole, che non è possibile ottenere del tutto puro e isolare, data la sua grande tendenza alla policondensazione con formazione inizialmente di acidi oligosilicici, per esempio:
3H4SiO4 ⇄ 2H2O + H8Si3O10
e successivamente di acidi polisilicici, e infine di particelle colloidali di silice amorfa recante ancora un certo numero di gruppi OH.
Questa policondensazione avviene spontaneamente nel caso delle soluzioni sovrasature, e può essere facilitata per riscaldamento e regolando il pH della soluzione.
Lasciato all'aria, l'acido silicico perde lentamente una molecola di acqua e si trasforma in acido metasilicico (H2SiO3):
H4SiO4 → H2SiO3 + H2O
Per dimerizzazione con perdita di acqua dell'acido ortosilicico si ottiene l'acido disilicico (H6Si2O7); analogamente, da tre molecole di acido ortosilicico si ottiene l'acido trisilicico (H4Si3O8).
In genere da n molecole di acido ortosilicico si ottengono gli acidi polisilicici.
Sia l'acido disilicico, sia l'acido trisilicico e gli acidi polisilicici non esistono in natura allo stato libero e non si possono preparare in laboratorio, ma si trovano combinati con i metalli per formare disilicati e trisilicati.
I sali degli acidi silicici sono i silicati; tra questi solo quelli dei metalli alcalini (per esempio l' ortosilicato di sodio Na4SiO4 e il metasilicato di sodio Na2SiO3) sono solubili in acqua.
I silicati naturali costituiscono i minerali più abbondanti in natura, presenti in quasi un migliaio di diverse specie mineralogiche.
Studia con noi