Proteoglicani
Che cosa sono i proteoglicani?
I proteoglicani sono una classe di macromolecole organiche ad elevato peso molecolare costituite da brevi catene peptidiche associate ad una elevata componente glucidica.
Sebbene la natura delle molecole che formano i proteoglicani sia in effetti la medesima di quella che forma le glicoproteine, le differenti proporzioni tra di esse e la diversa organizzazione le collocano in una categoria a sé stante.
I proteoglicani rappresentano la componente maggiore della matrice extracellulare nei tessuti connettivi, oltre ad essere un componente essenziale delle membrane cellulari e della matrice esterna ad esse.
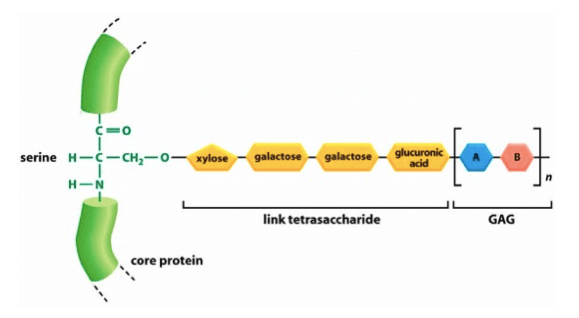
I proteolgicani sono costituiti da piccole catene peptidiche connesse a grandi catene glucidiche (glicosamminoglicani GAG) legate covalentemente alla serina attraverso un tetrasaccaride di collegamento.
Struttura e sintesi dei proteoglicani
Dal punto di vista strutturale lo schema compositivo dei proteoglicani è costituito da una catena peptidica di piccole dimensioni a cui sono legate lunghe catene di carboidrati dette Glicosamminoglicani.
La componente proteica rappresenta circa il 5% della molecola, mentre il restante 95 % è composto dalle catene glucidiche. Il legame tra le catene di carboidrati e lo scheletro proteico è di tipo N-glicosidico oppure O-glicosidico (si veda: legame glicosidico) e coinvolge l'amminoacido serina.
A questo residuo amminoacidico viene legato, nell'apparato di Golgi, un tetrasaccaride costituito da un monomero di xilosio, due monomeri di galattosio e una molecola di acido glucuronico.
All'estremità di questo tetrasaccaride vengono poi aggiunti, uno alla volta, i monosaccaridi che formeranno la catena del glicosamminoglicano, generalmente rappresentata dalla ripetizione di unità disaccaridiche uguali.
Differenza tra proteoglicani e glicoproteine
Sia i proteoglicani che le glicoproteine sono composti da una porzione proteica ed una porzione glucidica.
Nelle glicoproteine, però, la porzione glucidica è in percentuale assai minore rispetto ai proteoglicani, non superando mai il 60%, mentre nei proteoglicani rappresenta l'elemento principale.
Inoltre in tutte le glicoproteine i carboidrati sono strutturati in catene ramificate, corte e terminanti sempre con una molecola di acido sialico; nei proteoglicani, invece, le catene glucidiche sono lunghe, lineari e mancano sempre di questo specifico amminozucchero.
I glicosamminaglicani come componente dei proteoglicani
I glicosamminoglicani, detti anche mucopolisaccaridi, rappresentano la componente maggiore dei proteoglicani e sono strutturati in lunghe catene non ramificate di unità disaccaridiche.
I disaccaridi che formano i glicosamminoglicani contengono sempre un amminosaccaride, cioè una molecola di carboidrato in cui un gruppo funzionale ossidrilico è sostituito da uno amminico.
La caratteristica di queste molecole è quella di essere altamente idrofile portando alla formazione di molecole fortemente idratate.
Nei proteoglicani i glicosamminoglicani possono essere divisi in 4 classi:
- acido ialuronico : è l'unico proteoglicano che non contiene zolfo e la sua partecipazione alla formazione dei proteoglicani ha caratteristiche del tutto singolari;
- eparina e derivati: l'eparina contiene uno scheletro peptidico molto piccolo, formato da soli due residui amminoacidici (serina e glicina), con azione anticoaugulante. Un suo derivato, l'eparansolfato, forma una classe di proteoglicani fondamentali nella regolazione di processi di riconoscimento e differenziazione cellulare;
- condroitinsolfato (di tipo A, B, C): rappresenta il costituente principale delle cartilagini, conferendo ad esse la caratteristica elasticità;
- cheratansolfato ( di tipo 1 e 2): presenti rispettivamente nella cornea e nel tessuto connettivo lasso.
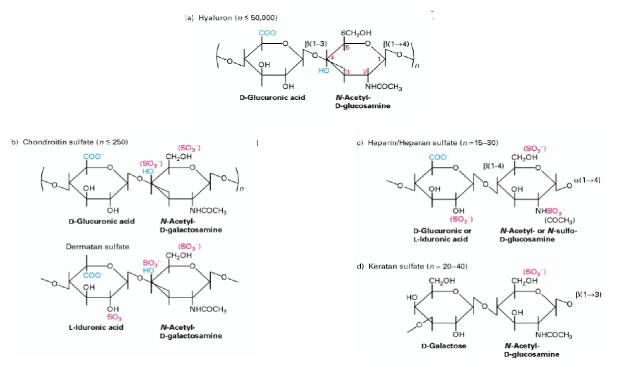
Struttura dei principali glicosamminoglicani.
Di questi, l'acido ialuronico è l'unico che non lega covalentemente l'asse proteico, ma partecipa alla formazione di complessi molecolari dalle dimensioni fuori dal comune per semplici molecole organiche, detti "aggrecani".
Questi particolari complessi proteoglicanici sono formati da una molecola di acido ialuronico attorno a cui si dispongono, legate non covalentemente, molte altre molecole di proteoglicano. Il risultato è una struttura che può pesare alcune decine di milioni di Dalton, raggiungendo le dimensioni di un batterio.
Funzioni dei proteoglicani
I proteoglicani sono molecole che svolgono molteplici funzioni. Essi sono innanzitutto la componente principale della matrice dei tessuti connettivi.
In questa veste, la capacità di idratarsi è fondamentale: i proteoglicani riescono infatti a formare dei gel idratati voluminosi e resistenti alla compressione che svolgono un ruolo chiave nella struttura dei tessuti connettivi e fungono da filtro molecolare, intrappolando le molecole ad alto peso molecolare e attraendo, insieme all'acqua, i cationi idratati.
Quest'ultima capacità è data dall'elevata carica negativa di questi composti, dovuta alla presenza di gruppi acidi e di solfuri che fanno di queste molecole dei polianioni basofili. Le piccole molecole idrosolubili invece possono diffondere agevolmente attraverso il gel.
Sulle membrane cellulari, in cui sono presenti come parte del glicocalice sia in veste di proteine transmembrana che di proteine esterne, ricoprono un ruolo importante come recettori e modulatori del differenziamento cellulare.
Proteoglicani ad eparansolfato
Tra i proteoglicani simili all'eparina vi sono quelli ad eparansolfato, molecole presenti come proteine transmembrana oppure libere nella matrice extracellulare, che agiscono come regolatori delle vie di segnalamento del differenziamento.
A titolo esemplificativo descriviamo l'azione di uno di essi, il sindecano, che agisce regolando l'azione dei fattori di crescita dei fibroblasti.
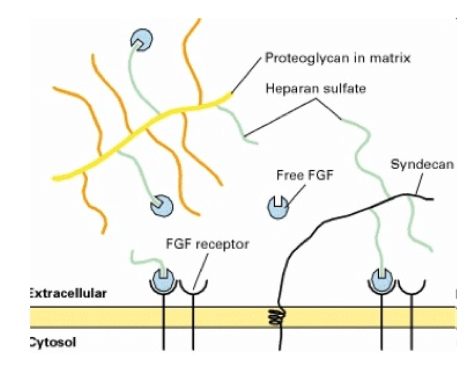
Meccanismo di azione del sindecano come regolatore dei fattori di crescita dei fibroblasti.
Questi composti legano degli specifici recettori di membrana ma normalmente l'affinità tra recettore e ligando è molto scarsa. Il sindecano è presente come proteina transmembrana ed è in grado di legare il fattore di crescita dei fibroblasti modificandone la struttura tridimensionale.
Questo cambiamento di conformazione rende il ligando fortemente affine al recettore, permettendone l'interazione e, di conseguenza, l'avvio della via metabolica da questo controllata.
Altri proteoglicani ad eparansolfato diffusi nella matrice, analogamente al sindecano, possono legare questi fattori rendendoli potenzialmente attivi. È probabile che questa azione trasformi tali fattori circolanti nella matrice in riserve di molecole attive pronte ad essere utilizzate.
Link correlati:
Qual è la differenza tra cellule procariotiche ed eucariotiche?
Quali sono le differenze tra la cellula animale e la cellula vegetale?
Studia con noi