Alcol deidrogenasi
Che cos'è l'alcol deidrogenasi?
L'alcol deidrogenasi (dall'inglese alcohol-dehydrogenase, comunemente noto come ADH) è uno degli enzimi più importanti presenti a livello epatico.
Funzioni e struttura dell'alcol deidrogenasi
L'alcol deidrogenasi catalizza la trasformazione da alcol in acetaldeide, tramite una reazione di ossidazione.
La sua azione è fondamentale, in quanto previene l'accumulo di alcol (sotto forma di etanolo) che sarebbe altrimenti dannoso per il nostro organismo.
Per comprendere al meglio quanto questo enzima sia indispensabile, si ricordi che l'accumulo di alcol può essere letale, in quanto può favorire l'insorgenza di disturbi cardiaci e vascolari di varia natura ed eziologia. Ad esempio, un soggetto che abusa di alcol può essere maggiormente soggetto a fenomeni di ipertensione arteriosa e, di conseguenza, ad un aumento del rischio di ictus cerebrale.
Pertanto, l'alcol deidrogenasi aiuta a difenderci da una delle molecole più tossiche che possono compromettere le funzioni del nostro sistema nervoso: l'alcol.
Alti livelli di questo enzima, a livello del fegato e dello stomaco, sono ritenuti positivi per lo smaltimento di superalcolici. Tuttavia, come accennato in precedenza, l'alcol viene trasformato in acetaldeide, la quale si è dimostrata essere una molecola ancora più tossica dello stesso alcol.
Quale è il vantaggio di tale conversione, dunque? Il vantaggio è che l'acetaldeide verrà trasformata in acido acetico per opera di un altro enzima, l'aldeide deidrogenasi. L'acido acetico non è una molecola tossica, a differenza delle due precedenti, quindi potrà essere utilizzato dalle nostre cellule.
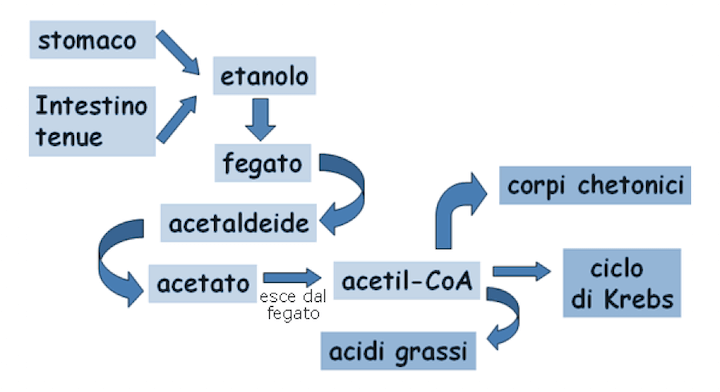
Nello schema della figura precedente (fig. 1), vediamo il percorso che porta sia alla formazione dell'acetato e sia il suo prosieguo nell'organismo. Infatti, l'acetato o acido acetico verrà convertito in Acetil Coenzima A il quale porterà alla formazione dei corpi chetonici, oppure entrerà nel ciclo di Krebs oppure porterà alla formazione degli acidi grassi.
Esistono diverse isoforme, cioè forme differenti, di questo enzima che si distinguono per avere differenti proprietà. La maggior parte di queste si trova concentrata nel fegato e sono tutte accomunate dall'avere due subunità le quali possono scambiarsi in quelle di forme diverse creando così dei dimeri misti, che rappresentano sempre delle forme attive dell'enzima.
Questo enzima si avvale di sue strutture per effettuare la conversione:
- L'atomo di zinco, che si utilizza per fermare nella giusta posizione il gruppo alcolico dell'etanolo e si trova sul sito attivo dell'enzima, tenuto in posizione da tre amminoacidi (istidina e due cisteine)
- Il coenzima NAD+, il quale compie la reazione di ossidazione.
Altre attività dell'alcol deidrogenasi
Abbiamo visto come questo enzima si leghi all'alcol (sotto forma di etanolo) per trasformarlo in un prodotto non tossico, ma rappresenta l'unico substrato al quale si lega? La risposta è negativa, infatti un altro substrato preferito è il metanolo, un alcol formato da un solo atomo di carbonio.
Quando l'alcol deidrogenasi si lega a questo alcol lo trasforma in formaldeide, la quale (come già è stato detto) è una molecola molto tossica. Se si accumula nell'organismo va ad attaccare le nostre proteine e le denatura, portando a sensibilizzazione allergica, effetti irritativi a livello di occhi, mucose respiratorie e pelle e, nei casi più gravi, cancerogenesi e mutagenesi.
Tossicità dall'accumulo di alcol
Essendo un enzima indispensabile per la trasformazione dell'alcol, una sua carenza o un eccesso di alcol possono portare a danni non indifferenti nel nostro organismo.
Ad esempio, l'assenza di alcol deidrogenasi comporta un accumulo sanguigno di acetaldeide, la quale comporta sintomi descritti in precedenza (tachicardia, ipertensione, vampate di calore, cefalea, ipotensione ecc).
La concentrazione di alcol deidrogenasi varia da popolazione a popolazione e da Paese a Paese. Questo fenomeno spiega la diversa sensibilità all'alcol di ognuno di noi, dovuta alla presenza di varianti genetiche che influiscono sulle attività enzimatiche degli enzimi coinvolti nel metabolismo dell'alcol.
Ad esempio, il gene ADH1B codifica per l'alcol deidrogenasi 2. Se l'attività di questo enzima risulta essere ridotta, si verifica un aumento degli effetti piacevoli dell'alcol che ne stimolano l'assunzione in maggiore quantità.
La variante A, maggiormente diffusa nelle popolazioni europee e più rara in quelle occidentali, manifesta un ruolo protettivo nei confronti di un abuso di alcol.
Al contrario, la presenza dell'allele G comporta una aumentata tendenza al consumo di alcolici. Tale variante ha una frequenza maggioritaria in tutte le popolazioni, escluse quelle orientali.
Il gene ADH1C, invece, codifica per l'alcol deidrogenasi 1C, noto come principale enzima epatico nel metabolismo dell'alcol etilico. Anche di questo enzima conosciamo diverse isoforme e varianti genetiche che possono ridurne l'attività. In particolare è stato visto come la presenza dell'allele G comporti una riduzione della capacità di metabolizzare l'etanolo.
È stato condotto uno studio sulla popolazione danese che ha rivelato come gli individui omozigoti (quindi con due stessi alleli) GG o eterozigoti (quindi con due alleli diversi) AG sembrino avere un maggior rischio nell'assumere maggiori quantità di alcol rispetto ai soggetti omozigoti per la variante A (quella più frequente).
Link correlati:
Che cosa è un isoenzima?
Studia con noi