Ubiquitina
Che cos'è l'ubiquitina?
L'Ubiquitina è una molecola fondamentale per la sopravvivenza di tutti gli organismi eucarioti.
La sua importanza è tale da essere presente in tutte le cellule dell'organismo e di essere estremamente conservata. Questa affermazione sta a significare che la struttura dell'Ubiquitina è praticamente identica in ogni organismo eucariote.
Per comprendere l'entità di questa circostanza, basti pensare che tra l'Ubiquitina presente in una cellula di lievito e quella presente nelle cellule umane vi sono solamente 3 amminoacidi di differenza, a testimoniare l'estrema importanza dei processi mediati da questa molecola, che non possono differire in alcun modo in tutti gli organismi.
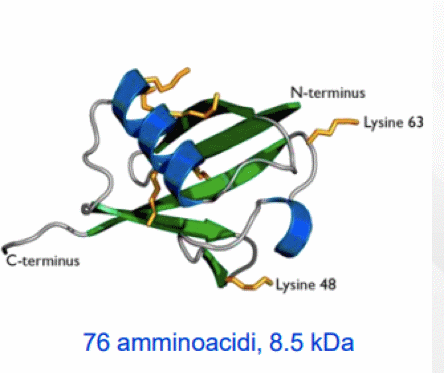
Ubiquitina, molecola fondamentale per il turn over cellulare.
Struttura dell'Ubiquitina
L'ubiquitina è formata da una catena di 76 amminoacidi di natura termostabile la cui struttura terziaria evidenzia la presenza di 1 elica alfa e 4 filamenti beta.
Il ripiegamento tridimensionale è tale da lasciare in evidenza, esposti esternamente, dei residui di Lisina posti in posizione mediana lungo la catena. Questi residui sono fondamentali perché partecipano al legame isopeptidico tra varie molecole di Ubiquitina. Perché l'Ubiquitina possa svolgere la sua funzione principale, infatti, è necessario che sia presente sotto forma di catena, in cui siano legate insieme almeno 4 molecole.
Il legame isopeptidico si genera per unione tra il gruppo amminico della Lisina laterale di una delle due molecole e quello carbossilico della Glicina terminale dell'altra.
Questo legame è un legame peptidico anomalo, perché coinvolge un gruppo amminico di catena laterale anziché terminale, come avviene di solito. La formazione di questo tipo di legame richiede idrolisi di ATP.
Funzioni dell'Ubiquitina
La funzione principale dell'Ubiquitina è di segnalare le proteine destinate alla degradazione. Tale destino è riservato alle proteine danneggiate, a quelle vecchie (per il normale turn over proteico della cellula) e a quelle proteine la cui vita è fisiologicamente molto breve, come le cicline e le proteine di regolazione dell'espressione genica, la cui presenza è funzionale ad una specifica e circoscritta necessità fisiologica della cellula.
Oltre a questa funzione, l'Ubiquitina pare svolga anche altre funzioni, legate alla riparazione del DNA, alla regolazione dei processi trascrizionali, al trasporto di materiale dall'interno all'esterno della cellula e all'apoptosi, ossia la morte cellulare programmata.
Ubiquitina come segnale per la degradazione delle proteine
Quando una proteina, per le ragioni summenzionate, è destinata ad essere distrutta, viene “segnata” attraverso il legame con una catena di almeno 4 molecole di Ubiquitina.
Il processo di formazione di questo legame coinvolge tre enzimi: l'enzima E1: questo enzima lega la coda dell'Ubiquitina determinandone l'attivazione. Una volta attivata, l'Ubiquitina viene coniugata dall'enzima E2, che la preleva dal complesso Ubiquitina-E1 formato precedentemente.
A questo punto entra in gioco l'enzima E3, che ha una forma a tenaglia e riesce a legare da una estremità la proteina da degradare e dall'altra l'Ubiquitina attivata e coniugata.
Quando l'Ubiquitina e la proteina bersaglio sono tenute vicine dal legame con la tenaglia E3, l'enzima Ubiquitina-Proteina-Ligasi catalizza la sintesi del legame tra le due.
La presenza di almeno quattro molecole di Ubiquitina legate tra loro consente al complesso di essere attaccato dal proteasoma che compirà la degradazione della proteina.
Le molecole di Ubiquitina che rimangono intatte vengono rimosse grazie all'azione di specifici enzimi e riciclate dal sistema cellula.
Quando l'Ubiquitina svolge una delle altre funzioni alternative alla segnalazione per la degradazione delle proteine, il legame con le molecole bersaglio si ferma ad una sola molecola di Ubiquitina, anziché 4.
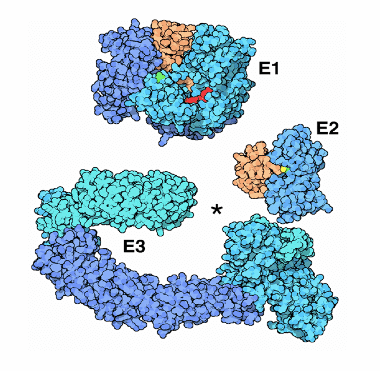
Proteine E1, E2 ed E3. L'asterisco indica il punto della "tenaglia" dove si realizza l'avvicinamento tra Ubiquitina e proteina bersaglio.
Sintesi dell'Ubiquitina
Le molecole di Ubiquitina sono prodotte per trascrizione e traduzione di sequenze geniche che non sono mai isolate: in alcuni casi esse sono associate a sequenze codificanti per altre proteine e sono trascritte insieme in un unico di mRNA.
La traduzione di tale mRNA porta alla formazione di un complesso Ubiquitina-proteina accessoria, che viene risolto da enzimi specifici, detti idrolasi c-terminali, che separano quindi le due molecole rendendole indipendenti.
In altri casi, i geni codificanti per l'Ubiquitina non sono associati a geni relativi ad altre proteine ma piuttosto sono organizzati in ripetizioni sequenziali di geni uguali, cosicché il trascritto produrrà delle catene lineari di poliubiquitina. Lo stessa enzima idrolasi c-terminale provvederà alla liberazione dei singoli monomeri.
Come fa l'Ubiquitina a determinare la degradazione delle proteine?
Sebbene alcune proteine molto piccole possano essere degradate anche senza l'ausilio dell'Ubiquitina, nella stragrande maggioranza dei casi la poliubiquitinizzazione (cioè il legame con più molecole di Ubiquitina) è necessario per portare una proteina alla sua demolizione.
Come abbiamo già detto, la molecola responsabile in solido della degradazione delle proteine è il complesso del proteasoma, i cui siti attivi consentono la distruzione della catena amminoacidica della proteina stessa.
Quasi tutte le proteine possiedono una intrinseca affinità con il proteasoma, che ne determina il legame casuale all'interno dell'ambiente cellulare. In assenza dell'Ubiquitina, però, tale legame è debole, così la proteina nella maggior parte dei casi si libera prima che il proteasoma riesca a degradarla.
In presenza di una poliubiquitinizzazione, invece, il legame si stabilizza ed il proteasoma riesce a compiere il processo di degradazione per cui è programmato.
Meno noti sono invece i meccanismi che consentono all'Ubiquitina di identificare le proteine destinate alla distruzione e discriminarle da quelle ancora necessarie al funzionamento cellulare.
Per alcune classi di proteine pare che la fosforilazione o glicosilazione di alcuni amminoacidi come la Serina e la Treonina posti in specifiche regioni possano accelerare o rallentare l'innesco della loro distruzione; alcune sequenze terminali di amminoacidi pare che possano essere correlate a emivite più o meno brevi dei composti, ma quale sia il meccanismo preciso di interazione non è ancora cosa nota.
Link correlati:
Che cos'è l'ecogenetica?
Studia con noi