Formazione di dioli geminali
Idratazione di aldeidi e chetoni
L'idratazione di aldeidi e chetoni, conseguente alla addizione di acqua al gruppo carbonilico, porta alla formazione di dioli geminali.
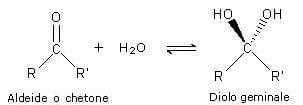
Nella reazione si ha che l'idrogeno dell'acqua si lega all'atomo di ossigeno del gruppo carbonilico, mentre il gruppo idrossilico si lega al carbonio.
la reazione di addizione di acqua ad aldeidi o chetoni è molto lenta a pH 7 (pH neutro) ma procede velocemente via via che il pH diminuisce (catalisi acida) o via via che aumenta (catalisi basica).
Meccanismo della idratazione acido-catalizzata
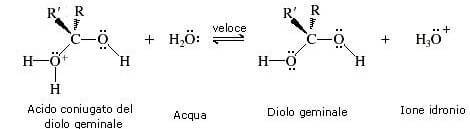
Il meccanismo della idratazione acido-catalizzata prevede tre stadi.
Nel primo stadio della reazione viene protonato l'ossigeno del gruppo carbonilico.
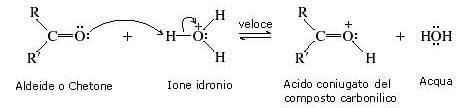
In questo modo il carbonio carbonilico viene reso molto più elettrofilo. Ciò è evidenziato dalle seguenti forme di risonanza:
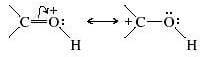
Nel secondo stadio della reazione (stadio lento) l'acqua effettua un attacco nucleofilo al carbonio carbonilico.
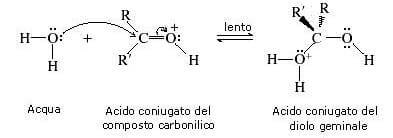
Nel terzo stadio della reazione una molecola di acqua strappa un protone all'acido coniugato del diolo geminale.
Si forma il diolo geminale e viene rigenerato lo ione idronio (catalizzatore acido).
Meccanismo della idratazione base-catalizzata
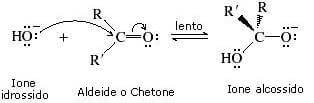
Il meccanismo della idratazione base-catalizzata prevede due stadi.
Nel primo stadio della reazione (stadio lento) si ha un attacco nucleofilo dello ione idrossido al carbonio carbonilico. Si viene a formare uno ione alcossido.
Nel secondo stadio della reazione lo ione alcossido strappa un protone all'acqua generando il diolo geminale.
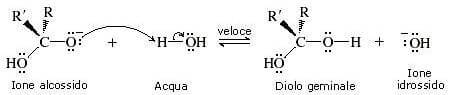
Fattori che influenzano l'equilibrio
La reazione di idratazione di aldeidi e chetoni è una reazione all'equilibrio. La posizione dell'equilibrio è influenzata sia dall'ingombro sterico che dagli effetti elettronici dei gruppi R legati all'atomo di carbonio.
Vediamo innanziutto in che modo l'ingombro sterico dei sostituenti e quindi le dimensioni dei gruppi R legati all'atomo di carbonio carbonilico influenzano l'equilibrio.
Durante la reazione di idratazione l'ibridazione dell'atomo di carbonio carbonilico passa da sp2 (angoli di legame 120°) a sp3 (angoli di legame 109,5°). Ci si può aspettare, quindi, che sostituenti R molto ingombranti siano meglio tollerati nei reagenti, dove gli angoli di legame sono maggiori. Gruppi R ingombranti destabilizzano maggiormente i prodotti di reazione (dioli geminali) e spostano l'equilibrio verso i reagenti facendo diminuire il valore della costante di equilibrio.
Vediamo ora di capire come l'effetto induttivo dei sostituenti R legati all'atomo di carbonio carbonilico influenza l'equilibrio della reazione. In generale, gruppi alchilici legati all'atomo di carbonio carbonilico tendono a stabilizzare l'atomo di carbonio polarizzato positivamente. Per tale motivo i chetoni sono più stabili delle aldeidi. I chetoni pertanto tenderanno a idratarsi con maggiore difficoltà (proprio perché più stabili). Come conseguenza si ha che, nel caso dei chetoni, l'equilibrio è spostato a sinistra e che il valore della costante di idratazione è inferiore a quello delle aldeidi.
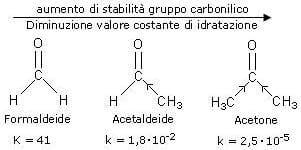
L'effetto sterico e quello induttivo agiscono quindi nel medesimo verso. Pertanto, a differenza dell'acetone, la formaldeide è completamente idratata.
Studia con noi