Costante di equilibrio
Costante di equilibrio e legge di azione di massa
Per una reazione all'equilibrio del tipo:
![]()
i norvegesi Cato Guldberg e Peter Waage, notarono che, una volta reggiunto l'equilibrio chimico, esisteva un rapporto costante tra le concentrazioni dei prodotti e quelle dei reagenti, ciascuna delle quali elevate al proprio coefficiente stechiometrico.
Tale relazione di equilibrio, viene data sotto la seguente forma:
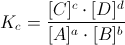
dove le concentrazioni sono quelle all'equilibrio e Kc è una costante nota come costante di equilibrio. Il suo valore numerico è caratteristico per ogni reazione chimica e dipende solo ed unicamente dalla temperatura (per info si veda: come varia il valore della costante di equilibrio con la temperatura).
Tale relazione è nota come legge di azione di massa o legge di Guldberg-Waage.
Legge di azione di massa
L'enunciato di tale legge è il seguente: a una data temperatura, in una reazione chimica all'equilibrio, il rapporto tra il prodotto delle concentrazioni dei prodotti elevate al proprio coefficiente stechiometrico e il prodotto delle concentrazioni dei reagenti elevate al proprio coefficiente stechiometrico, è un valore costante.
Quando la reazione avviene in fase gassosa, la costante di equilibrio può essere espressa in termini di pressioni parziali. La costante che si ottiene è detta Kp ed ha la seguente espressione:
![]()
La relazione che esite tra la Kp e la Kc è la seguente:
![]()
in cui:
- R = costante universale dei gas = 0,0821 (l · atm) / (mol · K)
- T = temperatura ssoluta
- Δn = differenza tra la somma dei coefficienti stechiometrici dei prodotti e la somma dei coefficienti stechiometrici dei reagenti = (c + d) - (a + b)
Se Δn = 0 allora Kp = Kc
È possibile anche esprimere la costante di equilibrio in termini di numero di moli:
![]()
La relazione che esite tra la Kc e la Kn è la seguente:
![]()
Se Δn = 0 allora Kc = Kn
A seconda del modo in cui viene scritta l'equazione chimica, il valore della Kc o della Kp assume valori diversi. Per la reazione:
![]()
Kp vale:
![]()
Dividendo tutti i coefficienti stechiometrici per due, si ottiene la seguente equazione chimica:
![]()
per la quale Kp vale:
![]()
è facile dimostrare che tra le due costanti esiste la seguente relazione:
![]()
Nella pratica, il valore della costante di equilibrio può assumere valori molto grandi (Keq >> 1) o anche molto piccoli (Keq << 1).
Se il valore della costante di equilibrio è molto grande (Keq >> 1) significa che la concentrazione dei prodotti è molto maggiore della concentrazione dei reagenti e che l'equlibrio è fortemente spostato a destra (verso i prodotti).
Se il valore della costante di equilibrio è molto piccolo (Keq << 1) significa che la concentrazione dei prodotti è molto minore della concentrazione dei reagenti e che l'equlibrio è fortemente spostato a sinistra (verso i reagenti).
Si tenga conto infine che il valore della Keq non dà alcuna informazione sul tempo con cui verrà raggiunto l'equilibrio e quindi sulla velocità di reazione.
Esercizi sugli equilibri
Li trovi svolti ed online al seguente link: esercizi sugli equilibri.
Link correlati:
Quiz online sulla costante di equilibrio
Esercizio svolto sulla legge di azione di massa
Studia con noi