Teoria VSEPR
Previsione della geometria di una molecola tramite la teoria VSEPR
Nel 1957 i chimici R. Nyholm e R. Gillespie misero a punto una teoria che permetteva di prevedere la geometria delle molecole.
Tale teoria fu chiamata VSEPR, acronimo della denominazione inglese Valence Shell Electron Pair Repulsion cioè repulsione tra doppietti elettronici del guscio di valenza.
Secondo tale teoria le coppie di elettroni più esterne, avendo tutte la stessa carica negativa, tendono a respingersi le une con le altre e a disporsi il più lontano possibile.
Nella teoria VSEPR bisogna tenere conto di tutte le coppie di elettroni del guscio di valenza, sia quelle coinvolte nella formazione di legami chimici (doppietti condivisi), sia quelle che non partecipano alla formazione di alcun legame (doppietti solitari).
I legami covalenti doppi e i legami covalenti tripli sono considerati alla stregua di semplici legami e la geometria della molecola dipende quindi unicamente dal numero di legami, indipendentemente dal fatto che siano legami singoli, doppi o tripli.
Inoltre, secondo tale teoria, i doppietti solitari tendono ad occupare un volume maggiore rispetto ai doppietti condivisi ed esercitano quindi una forza repulsiva di maggiore intensità.
In linea di massima la forza repulsiva tra coppie di elettroni varia nel seguente modo:
repulsione tra doppietti solitari > repulsione tra doppietti solitari e doppietti condivisi > repulsione tra doppietti condivisi
Per determinare la geometria molecolare è necessario calcolare il valore del numero sterico NS sommando il numero di atomi (X) legati all'atomo centrale (A) e il numero di coppie di elettroni libere presenti sull'atomo centrale (E).
In base a questo valore è possibile prevedere la geometria della molecola.
Ogni molecola potrà essere rappresentata con la formula generica AXmEn in cui A rappresenta l'atomo centrale, X il numero di atomi legati all'atomo centrale ed E le coppie di elettroni solitarie presenti sull'atomo centrale.

Nello studio di questo argomento è consigliato l'utilizzo di modellini molecolari necessari per comprendere la struttura e la geometria delle molecole. Vi rimandiamo al link per un eventuale acquisto del prodotto.
NS = 2 ; geometria lineare
Per molecole con struttura AX2
La geometria lineare è assunta da quelle molecole il cui atomo centrale presenta due legami chimici e nessun doppietto solitario e che quindi hanno formula generica AX2. (A = atomo centrale; X = atomi legati all'atomo centrale).
Queste molecole risultano lineari
X—A—X
e i due legami si dispongono a 180° l'uno dall'altro.
Come si è detto, i legami doppi o tripli valgono come singoli legami e pertanto molecole come l'idruro di berillio BeH2,
H—Be—H
l'anidride carbonica CO2
O=C=O
e il cianuro di idrogeno HCN
H—C≡N
presentano tutte geometria lineare.
NS = 3 ; geometria trigonale planare
Per molecole con struttura AX3, AX2E.
Molecole con tre legami e nessun doppietto solitario sull'atomo centrale (molecole con formula generica AX3) assumono geometria trigonale planare con i legami disposti su un unico piano a 120° l'uno dall'altro.
Presentano questa geometria il tricloruro di boro (BCl3) e la formaldeide (H2CO):

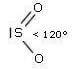
Molecole con due legami e una coppia di elettroni solitaria sull'atomo centrale (molecole con formula generica AX2E; E rappresenta la coppia di elettroni presente sull'atomo centrale) assumono geometria angolata (derivata dalla geometria trigonale planare). A causa della maggior repulsione della coppia solitaria sulle coppie di legame, l'angolo di legame risulta inferiore a 120°.
Presenta questa geometria l'anidride solforosa SO2:
Riassumendo:
NS = 3
Numero coppie solitarie = 0
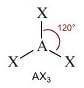
Geometria: trigonale planare
Numero coppie solitarie = 1
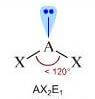
Geometria: angolata
NS = 4 ; geometria tetraedrica
Per molecole con struttura AX4, AX3E, AX2E2.
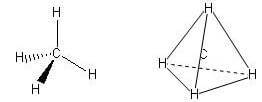
Molecole con quattro legami e nessun doppietto solitario sull'atomo centrale (molecole con formula generica AX4) assumono geometria tetraedrica con i legami disposti a 109,5° l'uno dall'altro.
Presenta questa geometria il metano (CH4) la cui struttura può essere rappresentata con legami a cuneo: quelli pieni indicano un legame che esce dal piano e si avvicina all'osservatore; quelli tratteggiati indicano un legame che si allontana dall'osservatore.
Molecole con tre legami e una coppia di elettroni solitaria sull'atomo centrale (molecole con formula generica AX3E; E rappresenta la coppia di elettroni presente sull'atomo centrale) assumono geometria piramidale (derivata dalla geometria tetraedrica).
A causa della maggior repulsione della coppia solitaria sulle coppie di legame, l'angolo di legame risulta essere inferiore a 109,5°.
Presenta questa geometria la molecola dell'ammoniaca NH3 nella quale gli angoli di legame sono di 107,3°:
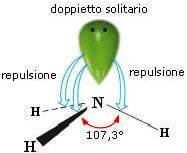
Molecole con due legami e due coppie di elettroni solitarie sull'atomo centrale (molecole con formula generica AX2E2) assumono geometria angolata (derivata dalla geometria tetraedrica).
Le due coppie solitarie occupano due vertici del tetraedro ed esercitando una forte repulsione nei confronti degli elettroni di legame, comprimono l'angolo di legame a valori inferiori rispetto a quelli caratteristici della geometria piramidale.
Presenta questa geometria la molecola dell'acqua H2O nella quale gli angoli di legame sono di 104,5°:
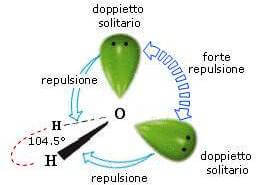
Riassumendo:
NS = 4
Numero coppie solitarie = 0
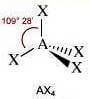
Geometria: tetraedrica
Numero coppie solitarie = 1
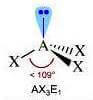
Geometria: piramidale trigonale
Numero coppie solitarie = 2

geometria: angolata
NS = 5 ; geometria bipiramidale trigonale
Per molecole con struttura AX5, AX4E, AX3 E2, AX2 E3.
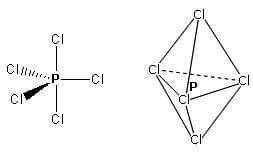
Molecole con cinque legami e nessun doppietto solitario sull'atomo centrale (molecole con formula generica AX5) assumono geometria bipiramidale trigonale con tre legami equatoriali disposti su un unico piano a 120° l'uno dall'altro e altri due legami detti assiali disposti rispettivamente sopra e sotto il piano dei legami equatoriali.
Presenta questa geometria la molecola del pentacloruro di fosforo PCl5:
Riassumendo:
NS = 5
Numero coppie solitarie = 0
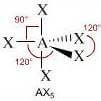
Geometria: bipiramidale trigonale
Numero coppie solitarie = 1
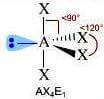
Geometria: altalena o cavalletto
Numero coppie solitarie = 2
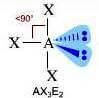
Geometria: forma a T
Numero coppie solitarie = 3
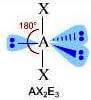
geometria lineare
NS = 6 ; geometria ottaedrica
Per molecole con struttura AX6, AX5E, AX4E2, AX3E3, AX2E4
Molecole con sei legami e nessun doppietto solitario sull'atomo centrale (molecole con formula generica AX6) assumono geometria ottaedrica con quattro legami equatoriali disposti su un unico piano a 90° l'uno dall'altro e due legami assiali disposti rispettivamente sopra e sotto il piano dei legami equatoriali.
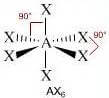
Presenta questa geometria la molecola dell'esafluoruro di zolfo SF6.
Riassumendo:
NS = 6
Numero coppie solitarie = 0
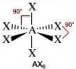
Geometria: ottaedrica
Numero coppie solitarie = 1
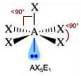
Geometria: piramidale quadrata
Numero coppie solitarie = 2
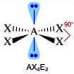
Geometria: planare quadrata
Numero coppie solitarie = 3
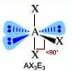
Geometria: forma a T
Numero coppie solitarie = 4
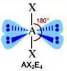
Geometria: lineare
NS = 7 ; geometria bipiramidale pentagonale
Per molecole con struttura AX7, AX6E, AX5E2, AX4E3, AX3E4, AX2E5
Molecole con sette legami e nessun doppietto solitario sull'atomo centrale (molecole con formula generica AX7) assumono geometria bipiramidale pentagonale con cinque legami equatoriali disposti su un unico piano a 72° l'uno dall'altro e due legami assiali disposti rispettivamente sopra e sotto il piano dei legami equatoriali.
Presenta questa geometria la molecola dell'eptafluoruro di iodio (IF7)
Riassumendo
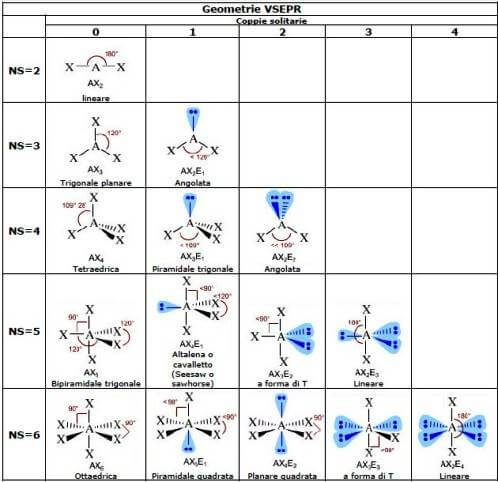
Di seguito sono rappresentate le possibili geometrie molecolari suddivise in base al valore del numero sterico NS e al numero di coppie solitarie presenti sull'atomo centrale:
Esercizi sulla teoria VSEPR
Esercizi sulla teoria VSEPR e sulla geometria delle molecole li trovi al seguente link: esercizi sulla teoria VSEPR.
Link correlati:
Che cos'è l'ibridazione sp3 del carbonio?
Studia con noi