Molecola polare
Quando una molecola è polare?
Un dipolo si forma quando due cariche di uguale intensità ma di segno opposto sono collocate a una certa distanza r: il più semplice dipolo elettrico è costituito da due cariche elettriche uguali +Q e -Q a distanza r.
Al dipolo è associato un certo momento di dipolo ( µ ) dato dal prodotto tra l'intensità di carica Q e la distanza r:
![]()
Il momento dipolare può essere rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo.
Molecole polari
Alcune molecole, dette polari, presentano un momento di dipolo totale (dovuto alla dislocazione delle cariche elettriche nella molecola) diverso da zero.
Infatti, in una molecola, i dipoli associati a ogni singolo legame covalente polare possono essere rappresentati con dei vettori: la somma dei vettori determina il dipolo totale associato alla molecola:
- se la somma vettoriale dei vettori associati a ogni singolo legame covalente polare non è nulla, allora la molecola è polare;
- se la somma vettoriale dei vettori associati a ogni singolo legame covalente polare è nulla, allora la molecola è non polare (o, in modo equivalente, apolare).
Pertanto, dire che una molecola ha legami covalenti polari non significa dire che molecola è polare: la polarità dipende infatti anche dalla geometria della molecola.
Molecole polari: il caso delle molecole biatomice
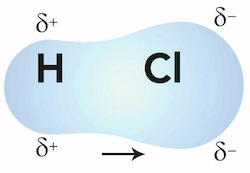
Una molecola biatomica è polare se il legame che tiene uniti i due atomi è di tipo covalente polare: è il caso dell'acido cloridrico la cui formula chimica è HCl.
Nella molecola dell'HCl, l'idrogeno e il cloro sono uniti da un legame covalente di tipo polare: la differenza di elettronegatività tra i due atomi è infatti 0,9.
L'atomo di cloro, più elettronegativo, assume una parziale carica negativa (δ−) mentre l'atomo di idrogeno, meno elettronegativo, assume una parziale carica positiva (δ+). Il dipolo associato alla molecola corrisponde al dipolo associato all'unico legame covalente presente.
Il legame covalente polare (tra H e Cl) può essere pertanto rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo (e quindi verso l'atomo di cloro).
Molecole polari: il caso della molecola dell'acqua
La formula chimica dell'acqua è H2O: l'atomo di ossigeno lega i due atomi di idrogeno mediante due legami covalenti polari. L'atomo di ossigeno, avendo una elettronegatività maggiore di quella dell'idrogeno, assume una parziale carica negativa (δ−), mentre l'idrogeno assume una parziale carica positiva (δ+).
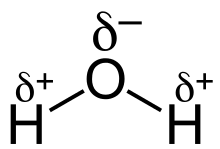
Ogni singolo legame covalente polare (tra O e H) può essere pertanto rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo (e quindi verso l'atomo di ossigeno).
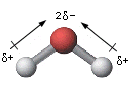
Siccome la molecola dell'acqua non è lineare ma ha geometria angolare, in cui l'angolo H-O-H risulta essere di 104,5°, possiamo asserire che la molecola dell'acqua è polare in quanto i dipoli associati ad ogni singolo legame covalente non si annullano tra di loro ma forniscono un dipolo risultante (dato dalla somma vettoriale dei singoli vettori) che determina la polarità complessiva della molecola.
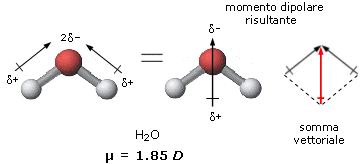
La molecola dell'acqua è polare in quanto i legami covalenti presenti nella molecola sono polari e i dipoli associati ai due legami covalenti sono disposti in maniera da non annullarsi.
Se la molecola dell'acqua fosse stata lineare, (in questo caso l'angolo H-O-H sarebbe stato di 180°) allora i due dipoli si sarebbero annullati e pertanto la molecola dell'acqua sarebbe stata apolare (= non polare).
Per ulteriori info: perché l'acqua è polare? Ti potrebbe interessare: molecole apolari.
Allo stesso modo, la molecola del difluoruro di ossigeno (OF2) è polare perché i legami covalenti sono polari e disposti in maniera da non annullarsi:
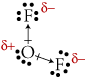
La molecola del difluoruro di ossigeno è polare perché i legami covalenti sono polari e disposti in maniera da non annullarsi: si noti che il verso dei vettori è rivolto verso l'atomo di fluoro più elettronegativo.
Una molecola formata da solo legami covalenti non polari, può essere polare?
Se una molecola è costituita da solo legami covalenti apolari, non potrà mai essere una molecola polare: i singoli legami covalenti sono non polari e quindi non polare risulterà anche la molecola.
Quando le molecole (che presentano legami covalenti polari) sono polari?
Come si è visto riguardo alla teoria VSEPR, ogni molecola può essere rappresentata con la formula generica AXmEn in cui:
- A = atomo centrale
- X = atomi legati all'atomo centrale
- E = coppie di elettroni solitarie presenti sull'atomo centrale
Supponiamo che gli atomi X legati all'atomo centrale A siano identici e che il legame tra A e X sia di tipo covalente polare. La molecola AXmEn è polare se assume le seguenti geometrie molecolari:
NS = 3
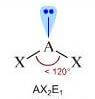
NS = 4
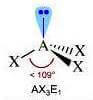

NS = 5
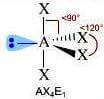
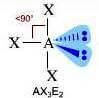
NS = 6
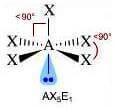
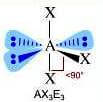
Link correlati:
Qual è il calore specifico dell'acqua?
Quali sono le proprietà solventi dell'acqua?
Studia con noi