Solvatazione
Che cos'è la solvatazione?
La solvatazione è un processo chimico che consiste nella formazione di complessi tra solvente e soluto; nel processo di solvatazione le molecole del soluto sono circondate e portate in soluzione dalle molecole del solvente. La solvatazione è perciò possibile quando il soluto si scioglie nel solvente (si ha quindi solubilità).
Una regola generale della solubilità indica che "i simili sciolgono i simili". Quindi:
1) i solventi polari risultano ottimi solventi di soluti polari o di solidi ionici. Acqua ed etanolo, per esempio, sono solubili l'uno nell'altro e in tutte le proporzioni poiché sono entrambi liquidi polari. Quando essi si mescolano, si ha processo di solvatazione:
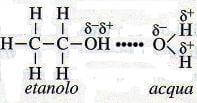
Solvatazione dell'etanolo da parte dell'acqua.
2) i solventi non polari sono buoni solventi di liquidi e solidi non polari. I grassi ad esempio sono solubilizzati solo da solventi non polari, quali benzina, trielina, tetracloruro di carbonio, ecc. Quando essi si mescolano, si ha processo di solvatazione.
Si tiene a precisare però che, nel caso in cui il solvente responsabile della solvatazione sia acqua, il processo di solvatazione prende il nome di idratazione.
Nel fenomeno della solvatazione i legami intermolecolari in gioco possono essere di diversa natura:
- interazione dipolo-dipolo;
- interazione dipolo istantaneo-dipolo indotto (forze di London);
- legame a idrogeno.
Idratazione di solidi ionici
I solidi ioni (come ad esempio NaCl) sono formati da un'alternanza di cariche positive (Na+) e negative (Cl−) che nell'insieme costituiscono il cristallo ionico.
Le molecole di acqua, dipolari, inizialmente si orientano attorno agli ioni che costituiscono la superficie del cristallo, alcune con la parte negativa verso gli ioni positivi (Na+) e altre con la parte positiva verso gli ioni negativi (Cl−); esse indeboliscono così le forze coulombiane fra gli ioni e penetrano sempre più profondamente nel reticolo cristallino iniziando così il processo di dissoluzione degli ioni, che vengono così progressivamente scalzati dalle loro posizioni reticolari.
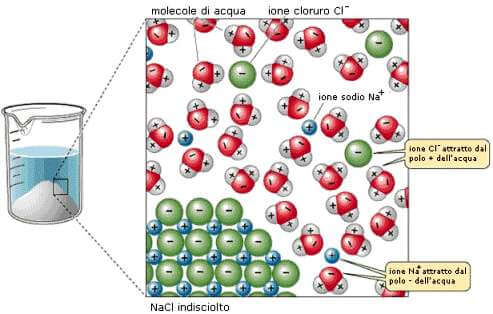
Dissoluzione del cloruro di sodio (NaCl) con formazione di solvati.
Nell'acqua le molecole H2O sono legate fra loro mediante legame idrogeno; considerando però che l'energia di questo legame (circa 20 kJ/mol) è minore delle energie dei legami dipolari ione-molecola H2O, può ritenersi che praticamente tutte le molecole H2O presenti nell'acqua liquida siano disponibili per la solvatazione degli ioni.
Il fatto poi che l'acqua abbia un elevato valore della costante dielettrica contribuisce sia a rendere più efficace l'opera di scalzamento degli ioni dal reticolo, sia, soprattutto, a mantenere questi separati fra loro nella soluzione.
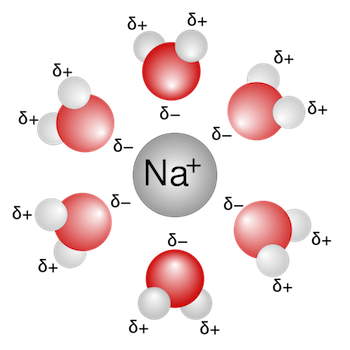
Solvatazione dello ione sodio Na+: la parte negativa della molecola dell'acqua (rappresentata dall'atomo di ossigeno) è rivolta verso lo ione sodio carico positivamente. Più molecole di acqua circondano lo ione sodio e lo solvatano.
Il descritto meccanismo del passaggio in soluzione di solidi ionici fa prevedere, fatto confermato dalla esperienza, che i cristalli ionici siano più solubili nei solventi più polari, perché con la polarità aumenta la capacità delle molecole di orientarsi attorno agli ioni ed aumenta la costante dielettrica.
Al fenomeno della solvatazione, cioè alla formazione di solvati, corrisponde una energia di solvatazione; perché il cristallo passi in soluzione, è necessario che l'energia di solvatazione sia maggiore dell'energia che lega fra loro gli ioni nel cristallo.
Solvatazione di solidi molecolari
In questo caso fra molecole di soluto e molecole di solvente possono formarsi legami dipolari, legami di van der Waals e, quando possibile, legami idrogeno. Così, ad esempio, il glucosio (C6H12O6) posto in acqua passa in soluzione essenzialmente per la formazione di legami idrogeno fra le molecole H2O ed i gruppi -OH della molecola del glucosio.
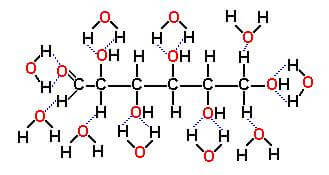
Solvatazione del glucosio da parte delle molecole dell'acqua H2O.
Numero di solvatazione
Il numero di molecole di solvente che circondano - nel processo di solvatazione - una particella di soluto, viene detto numero di solvatazione (se il solvente è acqua, si parla più propriamente di numero di idratazione).
Per lo ione sodio Na+ il numero di idratazione è compreso tra 4 e 6; per lo ione potassio K+ il numero di idratazione è compreso tra 2 e 6.
Energia di solvatazione
Al fenomeno della solvatazione, cioè alla formazione di solvati, corrisponde una energia di solvatazione; perché il soluto passi in soluzione, è necessario che l'energia di solvatazione sia maggiore dell'energia che lega tra loro le molecole di soluto.
I complessi di coordinazione sopra descritti si possono avere per qualsiasi solvente e non solo per l'acqua; nel caso dell'acqua come solvente il processo di solvatazione prende il nome di idratazione.
Studia con noi