Teoria degli Urti
Condizioni necessarie affinché avvenga una reazione chimica
Secondo la teoria degli urti, affinché avvenga una reazione chimica avvenga , si devono realizzare tre condizioni:
1) che le molecole dei reagenti urtino tra loro;
2) che le particelle durante l'urto siano correttamente orientate;
3) che l'urto sia sufficientemente violento
N.B. Se solo una di queste condizioni viene a mancare, la reazione non avviene.
Secondo tale teoria, quindi, la velocità di reazione dipende dalla frequenza degli urti sufficientemente violenti e correttamente orientati.
Che le molecole dei reagenti urtino tra loro
Per quanto riguarda la prima condizione, per aumentare il numero di urti, si può agire aumentando la concentrazione dei reagenti o anche aumentando la temperatura.
Infatti, un aumento di temperatura, determina un aumento di velocità delle particelle e quindi una maggior frequenza degli urti.
Che le particelle durante l'urto siano correttamente orientate
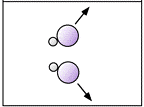
La seconda condizione afferma che, affinché l'urto sia efficace al fine di ottenere una reazione chimica, è necessario che la reciproca orientazione spaziale delle molecole durante l'urto sia corretta.
Quest'ultima condizione nota come "fattore sterico della reazione" ha notevole importanza nelle reazioni in cui sono interessate grosse molecole organiche, per le quali la possibilità di dare una certa reazione può risiedere soltanto in una particolare frazione della molecola, che costituisce solo una piccola frazione della sua superficie.
Il fattore sterico ha invece importanza assai minore in chimica inorganica ove le particelle che reagiscono (molecole, atomi o ioni) sono di norma di dimensioni molto minori.

Che l'urto sia sufficientemente violento
La terza condizione, infine, afferma che, affinché l'urto sia efficace al fine di ottenere una reazione chimica, deve avvenire con una energia di valore pari o superiore al valore dell'energia di attivazione.
Infatti, affinché due molecole reagiscano, è necessario che esse si avvicinino tanto da compenetrare le loro atmosfere elettroniche (che tendono a respingersi), costituendo così un'unica entità labile, il complesso attivato, che poi rompendosi dà luogo alle molecole dei prodotti della reazione.
Le variazioni di energia corrispondenti allo svolgimento della reazione:
A + B → C + D
sono rappresentate schematicamente nel grafico qui di seguito:
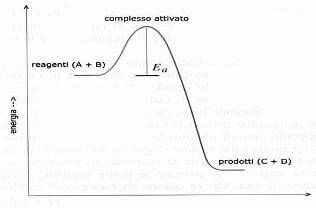
Le molecole A e B che reagiscono secondo la reazione
A + B → C + D
sono soltanto quelle il cui contenuto di energia ha un valore uguale o superiore al valore dell'energia di attivazione, cioè dell'energia richiesta per la formazione del complesso ativato.
Il complesso attivato ha un contenuto energetico molto alto e pertanto è molto instabile: rompendosi dà luogo alle molecole dei prodotti della reazione (C e D).
Il dislivello di energia tra reagenti e prodotti corrisponde alla variazione di entalpia ∆H.
Nelle reazioni esotermiche (come nel grafico precedente) il ∆H è negativo, mentre nelle reazioni endotermiche il ∆H è positivo.
Esercizi sui gas
Li trovi online e svolti al seguente link: esercizi sui gas.
Link correlati:
Che cosa sono e come agiscono gli inibitori?
Che cosa sono gli inibitori della corrosione?
Studia con noi