Energia di attivazione
Influenza dell'energia di attivazione sulla velocità di reazione
Secondo la teoria degli urti, affinché una reazione avvenga, le molecole devono urtarsi con una orientazione corretta e durante l'urto devono avere una energia sufficientemente elevata; l'energia di attivazione è l'energia minima che le molecole devono possedere durante l'urto, affinché la reazione avvenga.
La meccanica statistica insegna che, ad una data temperatura, le particelle possiedono energie cinetiche diverse che si distribuiscono secondo curve di frequenza dette maxwelliane:
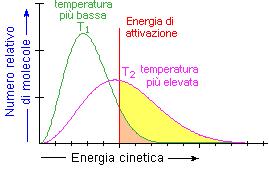
Distribuzione della energia cinetica delle particelle a diverse temperature (T2 > T1).
Osservando il grafico si può notare che all'aumentare della temperatura aumenta la frazione di molecole che ha una energia cinetica superiore al valore dell'energia di attivazione.
Stato di transizione e complesso attivato
Riportando in un grafico la variazione dell'energia potenziale di una reazione chimica rispetto al tempo di reazione t, l'energia di attivazione è una barriera energetica che i reagenti devono superare affinché possano trasformarsi nei prodotti di reazione (si veda immagine seguente).
Lo stato di transizione è una fase intermedia della reazione chimica che si ha quando i reagenti si stanno per trasformare nei prodotti di reazione.
A livello molecolare, allo stato di transizione corrisponde il complesso attivato che è un complesso altamente instabile nel quale i legami tra i reagenti si stanno rompendo e se ne stanno formando di nuovi.
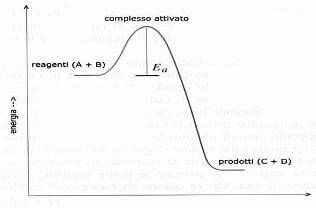
L'energia di attivazione, cioè l'energia minima necessaria perché si realizzi una reazione chimica, consente alle molecole dei reagenti (A e B) che collidono di formare il cosiddetto complesso attivato, che poi evolverà nei prodotti finali (C + D).
Come è possibile notare nella figura precedente, il valore dell'energia di attivazione corrisponde alla differenza tra il valore dell'energia del complesso attivato e il valore dell'energia dei reagenti.
Energia di attivazione e velocità di reazione
Nello studio della velocità di reazione, la svolta decisiva nell'interpretazione del fenomeno si ebbe quando il chimico svedese Svante August Arrhenius pubblicò, nel 1889, un classico lavoro nel quale, studiando l'effetto della temperatura sulle velocità di inversione del saccarosio, fece l'ipotesi che al processo partecipassero solo alcune delle molecole presenti, rese attive in quanto dotate di un eccesso di energia (energia di attivazione).
Il numero delle molecole attive varia con la temperatura (T) secondo la statistica di Maxwell-Boltzmann sopra citata e la costante di velocità k di una reazione è data dalla relazione:
![]()
in cui:
- A è un fattore che dipende dalla frequenza degli urti;
- E l'energia di attivazione;
- R è la costante universale dei gas.
Anche se questa relazione era stata in realtà sviluppata da Van't Hoff per le costanti di equilibrio, essa è nota come equazione di Arrhenius.
Nel 1918, calcolando la velocità di reazione delle reazioni bimolecolari, W.C. McLewis riuscì a interpretare il significato del fattore A che compare nell'equazione di Arrhenius mostrando che esso è uguale al numero di collisioni efficaci per unità di tempo. Da allora tutti gli sviluppi teorici della teoria delle collisioni si concentrarono sul calcolo del fattore di frequenza A e dell'energia di attivazione E.
Da tale formula si possono trarre importanti conclusioni:
- all'aumentare dell'energia di attivazione E il valore di K diminuisce e quindi la reazione chimica è più lenta;
- al diminuire dell'energia di attivazione E il valore di K aumenta e quindi la reazione chimica è più veloce.
È possibile modificare il valore dell'energia di attivazione?
I catalizzatori sono sostanze in grado di fornire un percorso di reazione alternativo avente una energia di attivazione inferiore rispetto alla reazione non catalizzata. Come è mostrato nella figura seguente, i catalizzatori abbassano pertanto il valore della energia di attivazione aumentando - di conseguenza - la velocità di reazione.
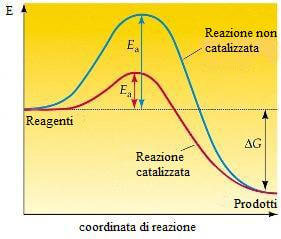
La reazione catalizzata (in rosso) ha una energia di attivazione inferiore rispetto alla reazione non catalizzata (in verde).
Importanti catalizzatori sono alcuni metalli (ferro, platino, palladio, argento, ecc.) e alcuni ossidi (ossido di alluminio, silice, ecc.).
Link correlati:
Che cosa sono e come agiscono gli inibitori?
Esercizio sullo studio della coordinata di reazione di una generica reazione chimica
Che cosa sono gli inibitori della corrosione?
Studia con noi