Leggi dei gas
Enunciati e spiegazioni delle leggi sui gas
Il comportamento di un gas è fortemente influenzato dalle variabili di stato: pressione, volume, temperatura; ci si può chiedere in quale modo tali grandezze fisiche influenzano lo stato gassoso: a tale domanda hanno risposto vari scienziati dei secoli passati.
È infatti possibile formulare relazioni matematiche che legano le variabili di stato per un gas; tali relazioni, che furono scoperte empiricamente tra il 1660 ed il 1803 e ottenute poi teoricamente mediante la meccanica statistica di Maxwell e quella quantistica di Boltzmann, sono note come leggi dei gas perfetti o leggi dei gas ideali.
In tali trattazioni ci si riferisce sempre ad un modello di gas detto gas ideale o gas perfetto che permette di studiare il gas secondo la teoria cinetico-molecolare.
Le leggi dei gas
Nelle prime tre leggi dei gas perfetti che studieremo viene mantenuta costante una delle tre variabili di stato (P, V, t) e si osserva come sono in relazione le restanti due variabili.
La quarta legge dei gas (legge di Avogadro) riguarda invece gas diversi mantenuti nelle medesime condizioni di temperatura e pressione.
La quinta legge dei gas invece mette in relazione contemporaneamente tutte e tre le variabili di stato in un'unica equazione.
Le leggi dei gas perfetti sono:
1) Legge di Boyle
La legge di Boyle o legge dell'isoterma vale quando la temperatura di un gas viene mantenuta costante; esprime pertanto la relazione fra pressione e volume di un gas a temperatura costante.
La legge di Boyle afferma che: il volume occupato da una massa di gas, mantenuta a temperatura costante, è inversamente proporzionale alla pressione alla quale esso viene sottoposto.
In termini matematici, la legge può essere così espressa:
P · V = k
in cui:
- P = pressione
- V = volume
- k = valore costante
Ciò significa che raddoppiando, triplicando, ecc. la pressione esercitata su una data massa di gas mantenuta a temperatura costante, il suo volume diventa la metà, un terzo, ecc. di quello iniziale.
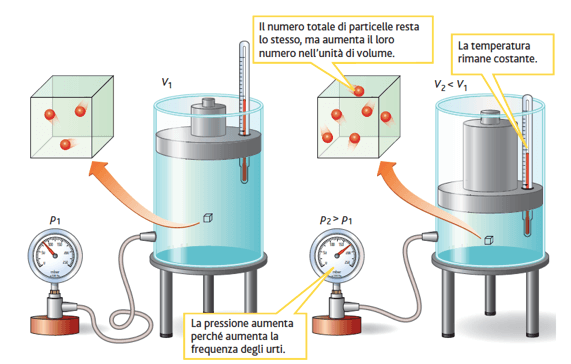
Secondo la legge di Boyle, a temperatura costante, un aumento di pressione esercitata su una massa di gas comporta una diminuzione del suo volume.
2) Legge di Charles
La legge di Charles o legge dell'isobara o prima legge di Gay-Lussac vale quando la pressione di un gas viene mantenuta costante; esprime pertanto la relazione tra volume e temperatura di un gas mantenuto a pressione costante.
La legge di Charles afferma che: a pressione costante, il volume di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta.
In termini matematici, la legge può essere così espressa:
V1 : T1 = V2 : T2
in cui:
- V1 = volume del gas alla temperatura T1
- T1 = temperatura assoluta del gas
- V2 = volume del gas alla temperatura T2
- T2 = temperatura assoluta del gas
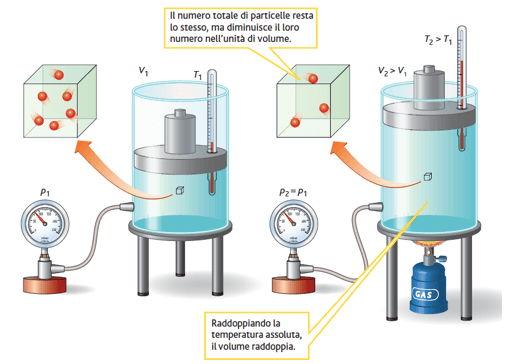
Secondo la legge di Charles, a pressione costante, un aumento della temperatura di una determinata massa di gas comporta un aumento del suo volume.
Più in particolare Charles scoprì che se una determinata massa di gas viene riscaldata a pressione costante, il suo volume aumenta di una quantità fissa per ogni grado centigrado di aumento della temperatura, pari 1/273 del volume iniziale.
Pertanto, detto V0 il volume del gas alla temperatura di 0°C è possibile determinare Vt ovvero il volume del gas ad una certa temperatura t in °C mediante la seguente equazione:
Vt = V0 · (1 + α · t)
in cui α è una costante che vale 1/273.
3) Legge di Gay-Lussac
La seconda legge di Gay-Lussac o legge dell'isocora vale quando il volume di un gas viene mantenuto costante; esprime pertanto la relazione tra pressione e temperatura di un gas mantenuto a volume costante.
La legge di Gay-Lussac afferma che: a volume costante, la pressione di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta.
In termini matematici, la legge può essere così espressa:
P1 : T1 = P 2 : T2
in cui:
- P1 = pressione del gas alla temperatura T1
- T1 = temperatura assoluta del gas
- P2 = pressione del gas alla temperatura T2
- T2 = temperatura assoluta del gas
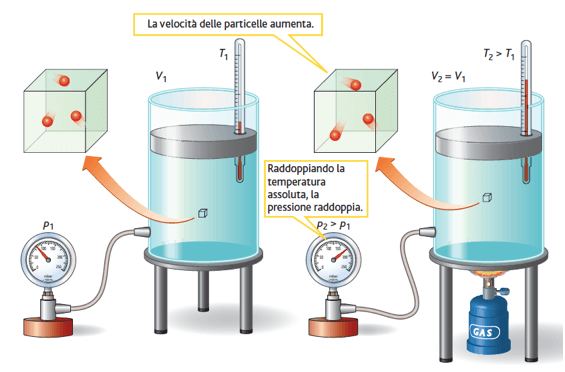
Secondo la legge di Gay-Lussac, a volume costante, un aumento della temperatura di una determinata massa di gas comporta un aumento della sua pressione.
Più in particolare Gay-Lussac scoprì che se una determinata massa di gas viene riscaldata a volume costante, la sua pressione aumenta di una quantità fissa per ogni grado centigrado di aumento della temperatura, pari 1/273 della pressione iniziale.
Pertanto, detto P0 la pressione del gas alla temperatura di 0°C è possibile determinare Pt ovvero la pressione del gas ad una certa temperatura t in °C mediante la seguente equazione:
Pt = P0 · (1 + α · t)
in cui α è una costante che vale 1/273.
4) Legge di Avogadro
La legge di Avogadro afferma che volumi uguali di gas diversi, nelle stesse condizioni di temperatura e di pressione, contengono lo stesso numero di particelle.
Quindi, ad esempio, ad una determinata temperatura e ad una determinata pressione, un litro di CO2 contiene lo stesso numero di particelle di un litro di H2.
5) Equazione di stato dei gas perfetti
Dalla combinazione delle tre leggi sperimentali sui gas e del principio di Avogadro, E. Clapeyron ottenne l'equazione di stato dei gas perfetti, che mette in relazione tutte e tre le variabili di stato in un'unica equazione. In termini matematici risulta che, per un gas ideale:
![]()
in cui:
- P = pressione
- V = volume
- n = numero moli
- T = temperatura
R invece è una costante chiamata costante universale dei gas (o semplicemente costante dei gas) che può assumere valori diversi a seconda delle unità di misura utilizzate.
Se la pressione P viene misura in atmosfere, il volume V in litri e la temperatura T in Kelvin, risulta:
![]()
Viceversa, se la pressione P è espressa in Pascal, il volume V in m3 e la temperatura T in Kelvin, risulta:
![]()
Esercizi sui gas
Li trovi online e svolti ai seguenti link:
Link correlati:
Esercizio su una trasformazione isocora di un gas
Esercizio su una trasformazione isobara di un gas
Esercizio su una trasformazione isoterma di un gas
Che cosa studia la meccanica dei fluidi?
Che cosa studia la gasdinamica?
Studia con noi