Trombina
Che cos'è la trombina?
La "trombina" è un importante enzima che interviene nella coagulazione del sangue.
Quando parliamo di coagulazione del sangue, intendiamo il risultato di una serie di processi (suddivisi in varie tappe) che portano alla formazione di un coagulo. Infatti, grazie alla formazione del tappo emostatico, in cui intervengono le piastrine (frammenti cellulari presenti nel sangue) e i fattori di coagulazione, diventa possibile riparare le lesioni e le ferite.
Struttura trombina
Tale enzima fa parte della famiglia delle "idrolasi", ossia quella categoria di enzimi che catalizzano l'idrolisi di un legame chimico sfruttando la molecola di acqua (H2O).
In particolare essa effettua un taglio dei legami Arg-Gly (arginina - glicina) del fibrinogeno per formare la fibrina. Ricordiamo che il fibrinogeno è una glicoproteina plasmatica sintetizzata nel fegato ed è un fattore essenziale per la coagulazione del sangue ed essa è una proteina solubile; tuttavia, la forma attiva è data proprio dalla fibrina, che invece rappresenta una proteina insolubile.
Inoltre la trombina appartiene alla famiglia delle "serin proteasi", in grado cioè di tagliare le catene proteiche.
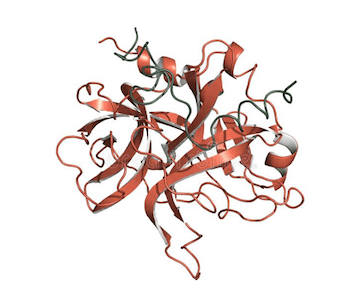
Fig.1 Struttura della trombina.
La trombina: il centro del processo di coagulazione del sangue
Dal momento che la trombina è fondamentale per il processo di coagulazione del sangue, vediamo di riassumerlo come segue:
- esiste un fattore tissutale localizzato sulla membrana di cellule che normalmente non sono in contatto con il flusso sanguigno, ma che in seguito a un taglio o una ferita, viene a contatto con il sangue;
- da qui inizia la segnalazione a piramide, cioè una cascata di eventi che producono una risposta atta ad arginare il danno;
- si attivano a cascata i fattori di coagulazione: il fattore di tessuto attiva le molecole del fattore VII, che a sua volta attiverà il fattore X che a sua volta attiverà tante molecole di trombina;
- attivata la trombina induce un taglio sul fibrinogeno facendolo aggregare in strutture più grandi fino a formare una fitta rete che intrappola le cellule del sangue;
- alla fine si formerà la crosta che chiude la ferita.
Meccanismi di controllo della coagulazione del sangue
Come si può immaginare, la cascata coagulativa deve essere controllata per evitare che il sangue possa coagulare in posti sbagliati e portare alla formazione di trombi o emboli. Di conseguenza diventa fondamentale controllare anche la trombina.
Quali sono, dunque, i meccanismi di controllo della trombina?
È possibile riassumerli in tre punti:
1) Dal momento che non è sempre necessaria la presenza della trombina (altrimenti il sangue coagulerebbe in continuo), è necessario attivarla solo al momento giusto. Pertanto essa si trova in una forma inattiva (come la maggior parte degli enzimi), chiamata protrombina.
Essa è quindi uno zimogeno, cioè una forma inattiva, quindi incapace di agire, che presenta più domini funzionali.
Nella figura seguente è rappresentata la struttura della protrombina: il sito attivo (quello che permetterà la trasformazione da zimogeno in enzima attivo) è rappresentato nella colorazione verde e contiene i tre amminoacidi chiave serina (Ser), istidina (His) e acido aspartico (Asp) localizzati al centro della figura.
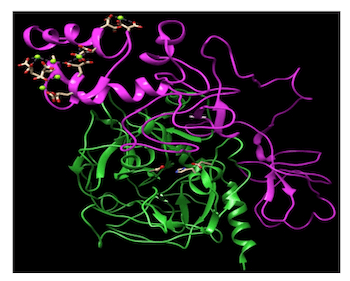
Fig. 2 Struttura della protrombina.
La parte in viola rappresenta la parte che verrà poi tagliata per far sì che resti solo quella attiva (in verde), quindi è questa che determina l'enzima nella forma inattiva.
Una cosa che salta all'occhio è che il sito attivo si trova esattamente al centro della molecola, pertanto diventa inaccessibile finché non si taglia la parte inattiva (in viola) che lo protegge.
2) Vediamo il secondo meccanismo di controllo: dove si trova la protrombina? Confinata nei vasi sanguigni, in particolare sulla superficie dei vasi (tonaca avventizia, quella più esterna), grazie alla carica positiva degli ioni calcio (Ca2+) legati a acidi carbossi glutammici (particolari acidi glutamminici modificati) in prossimità della parte finale della struttura. Pertanto, grazie a questa particolare localizzazione, essa potrà essere attivata solo in prossimità del vaso sanguigno leso.
3) Terzo (e ultimo) meccanismo di controllo è quello un po' più problematico, in quanto riguarda l'emivita della trombina che è molto breve, infatti dura qualche secondo. Questo da una parte rappresenta un vantaggio, in quanto siamo sicuri che il coagulo non si allontani formando un trombo o un embolo ma lo svantaggio è che la risoluzione del vaso leso dovrà essere altrettanto veloce ed immediata.
TAFI: Inibitore della fibrinolisi attivabile
Una volta che la trombina è stata attivata in seguito alla formazione del coagulo, la fibrina (forma attiva del fibrinogeno) attiva il TAFI, cioè una carbossipeptidasi che rimuove i residui terminali della lisina dalla superficie della fibrina, eliminando in questo modo dalla superficie del coagulo dei potenziali siti di legame per gli enzimi fibrinolitici. In questo modo si aumenterà la resistenza del coagulo ad una possibile fibrinolisi.
Se non venisse attivata questa TAFI, potrebbe aumentare l'emorragia nell'emofilia.
La trombina necessaria per attivare la fibrina in questione è dipendente dall'attività di un fattore tissutale. In sostanza, la stessa trombina che ha attivato il TAFI (noto come complesso trombina-trombomodulina) rimarrà associata al coagulo di fibrina/piastrine e sarà protetta dall'azione inibitrice dell'antitrombina.
Ruolo della trombina nella flogosi e riparazione delle ferite
È stato visto che tale trombina, oltre a partecipare al processo emostatico, è coinvolta anche nel processo flogistico ed in quello di riparazione delle ferite. Inoltre, gli agonisti che legano il recettore della trombina potrebbero accelerare la guarigione della ferita.
Link correlati:
Che cosa sono gli enzimi transferasi?
Studia con noi