Trasformazioni dei gas che avvengono senza scambi di calore
Trasformazioni relative ai gas perfetti che avvengono senza scambi di calore
Le trasformazioni relative ai gas perfetti che avvengono senza scambi di calore sono le trasformazioni adiabatiche.
Pertanto, in tali trasformazioni, la variazione della quantità di calore scambiata risulta nulla (ΔQ=0).
L'equazione associata ad una trasformazione adiabatica risulta essere l'equazione di Poisson:
P ∙ Vγ = cost
in cui P è la pressione, V il volume del gas e γ è il rapporto fra il calore specifico a pressione costante del gas e quello a volume costante.
γ = Cp / Cv
Tenendo presente l'equazione di stato dei gas perfetti, è possibile esprimere l'equazione di Poisson anche come:
T ∙ Vγ-1 = cost
ovvero:
T ∙ P(1-γ)/γ = cost
Grafico nel piano P-V
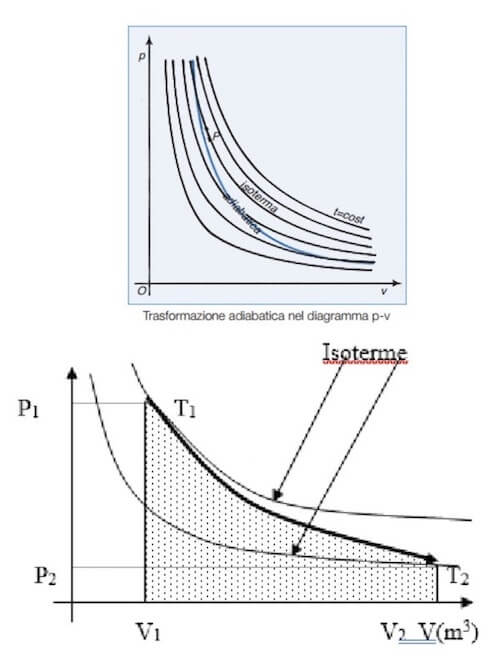
Relativamente ad una trasformazione adiabatica, il piano di Clapeyron riporta come grafico la curva rappresentata dall'equazione di Poisson.
Si tratta di un'iperbole non equilatera, ovvero un'iperbole più inclinata rispetto a quelle equilatere che rappresentano le isoterme.
In particolare poiché nella compressione adiabatica la temperatura del sistema deve aumentare, allora la curva adiabatica deve intersecare una iperbole equilatera superiore che rappresenta una temperatura maggiore rispetto a quella iniziale:
Il γ che compare nella formula è il rapporto fra il calore specifico a pressione costante del gas e quello a volume costante:
γ = Cp / Cv
Questo rapporto per la maggior parte dei gas a molecola biatomica (O2 , N2 , H2, e con buona approssimazione, anche per l'aria) assume il valore medio di 7/5, mentre per i gas monoatomici vale 5/3.
Relazione con il primo principio della termodinamica
Il primo principio della termodinamica nella sua forma generale:
ΔU = Q – L
risulta modificato in
ΔU = – L
in quanto il sistema non scambia calore con l'ambiente esterno.
Questo vuol dire che una compressione adiabatica (L<0) comporterà un aumento dell'energia interna (ΔU >0). E poiché l'energia interna è una funzione di stato della temperatura, cioè dipende solo da essa come variabile, l'effetto sarà quello di un aumento della temperatura finale del gas.
Viceversa un'espansione adiabatica (L>0) comporterà una diminuzione dell'energia interna (ΔU<0) con conseguente raffreddamento del gas.
Il lavoro termodinamico per una trasformazione adiabatica è pari a:
L = n ∙ Cv ∙ (T1 - T2) = (p2 ∙ V2 - p1 ∙ V1) / (1-γ)
in cui Cv è il calore specifico a volume costante ed n il numero di moli del gas.
Dunque possiamo anche scrivere che:
ΔU = - L = n ∙ Cv ∙ (T2 - T1) = (p2 ∙ V2 - p1 ∙ V1) / (γ-1)
Esercizio #1
Una certa quantità di aria inizialmente alla temperatura di 20°C subisce una compressione adiabatica reversibile al termine della quale risulta essere compresso di 10 volte rispetto al volume iniziale.
Considerando l'aria come un gas perfetto biatomico, calcolare la temperatura finale del gas.
Si sappia che per un gas biatomico γ = Cp / Cv = 7/5.
Lom svolgimento dell'esercizio lo trovi qui: esercizio sulla compressione adiabatica dell'aria.
Esercizio #2
Ai piedi di una montagna alta 4500 m si crea una depressione, per cui l'aria al suolo che si trova alla temperatura di 25°C viene richiamata molto velocemente in cima alla montagna per cui subisce un raffreddamento di 10°C ogni km di altezza percorso.
Considerando il processo adiabatico per la rapidità con cui avviene, determinare la pressione dell'aria in cima alla montagna.
Si sappia che per un gas biatomico γ = Cp / Cv = 7/5.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sul calcolo della pressione dell'aria in cima ad una montagna.
Studia con noi