Funzione d'onda
Che cosa sono le funzioni d'onda?
Così come un fotone di luce può essere interpretato sia come onda elettromagnetica (ad esempio per spiegare bene i fenomeni di interferenza) sia come particella (ad esempio per spiegare l'effetto fotoelettrico) anche una particella dotata di massa come ad esempio un elettrone può essere visto sia come particella, in maniera classica, ma anche come onda.
Questa assunzione fu necessaria per giustificare il fatto che le orbite degli elettroni attorno agli atomi assumevano solo valori discreti (quantizzazione di Bohr), non era cioè possibile assegnare all'elettrone un'energia qualsiasi e posizionarlo su infinite orbite. Ogni orbita doveva corrispondere ad un ben preciso numero intero.
Fu De Broglie che scoprì che anche alle particelle poteva essere assegnata una lunghezza d'onda λ detta lunghezza d'onda di de Broglie e pari al rapporto tra la costante di Planck h (6,626 ∙ 10-34 J∙s) e il modulo p della quantità di moto della particella, cioè il prodotto della sua massa m per la sua velocità v:
λ = h/p
Essendo h una costante molto piccola, dell'ordine di grandezza di 10-34 , ovviamente gli oggetti macroscopici che si muovono a velocità ordinarie hanno lunghezze d'onda di De Broglie talmente piccole da risultare trascurabili rispetto alle loro dimensioni. Invece, ad esempio, gli elettroni hanno lunghezze d'onda associate relativamente grandi se confrontate con le dimensioni di un atomo in quanto la loro massa che compare al denominatore è dell'ordine di 10-31.
Solo considerando l'elettrone come onda è possibile spiegare la condizione di quantizzazione di Bohr in quanto le uniche orbite permesse su cui può trovarsi l'elettrone attorno all'atomo devono essere tali da avere una lunghezza pari a n volte la lunghezza d'onda dell'elettrone altrimenti l'orbita non si può chiudere.

La teoria generale che trattava le cosiddette onde di materia (cioè materia che deve essere trattata come onda per la spiegazione dei fenomeni quantistici) fu proposta per la prima volta dal fisico Erwin Schrodinger nel 1926 con l'introduzione di una formula matematica che doveva definire in maniera strutturata e con un formalismo matematico posizione ed evoluzione temporale di una particella in un sistema di forze note quale quello che può essere definito un atomo.
In particolare Schrodinger derivò l'espressione di un'equazione fondamentale della fisica nota appunto come equazione di Schrodinger dalla cui risoluzione si trovano i livelli di energia discreti così come proposti da Bohr attraverso la sua teoria.
Inoltre per ogni livello di energia derivante da tale equazione si trova una diversa funzione chiamata funzione d'onda e indicata con la lettera greca "psi" Ψ.
Ogni funzione d'onda Ψ:
- rappresenta una delle soluzioni dell'equazione di Schrodinger
- dipende dalle tre coordinate spaziali x,y,z e dalla coordinata temporale t e si scrive dunque Ψ(x,y,z,t) per indicare tale dipendenza
- descrive completamente il comportamento quantistico di un sistema
L'equazione di Schrodinger è un'equazione differenziale molto complessa con una matematica che si studia prettamente a livello universitario. Per poter comprendere però come essa è legata al sistema energetico di un atomo proviamo a semplificarla notevolmente per farne capire il senso e il suo legame con la funzione d'onda che descrive lo stato di un sistema quantistico.
Ricordando le espressioni del modulo della quantità di moto p e dell'energia cinetica K di una particella di massa m che si muove a velocità v nella fisica classica:
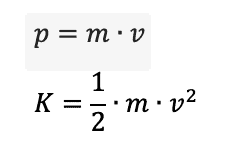
L'energia cinetica si può però anche scrivere utilizzando la quantità di moto p, infatti:
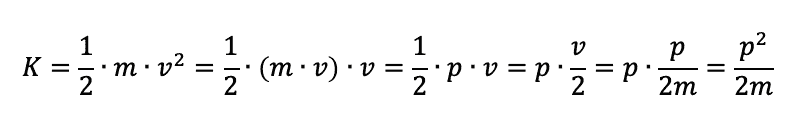
Per cui l'energia totale E associata alla particella di massa m risulterà pari alla somma della sua energia cinetica e dell'energia potenziale V:

Ora, in meccanica quantistica l'energia non è trattata come una quantità scalare, ma come un operatore matematico. Gli operatori sono strumenti matematici che agiscono su funzioni d'onda per fornire informazioni sullo stato quantico di un sistema. Nella rappresentazione matematica, l'energia è associata a un operatore chiamato operatore dell'energia ed indicato con Ê:
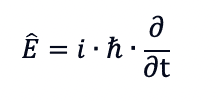
In cui i è l'unità immaginaria (i2 = -1), ћ è la costante di Planck ridotta - cioè h/(2π) -e ∂/∂t è la derivata parziale rispetto al tempo della funzione che va posta dopo l'operatore.
Anche la quantità di moto è trattata in meccanica quantistica come un operatore:
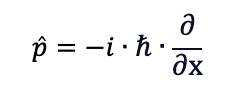
Analogamente all'operatore energia, i è l'unità immaginaria, ћ è la costante di Planck ridotta - cioè h/(2π) - e ∂/∂x è stavolta la derivata parziale rispetto alla posizione della funzione che va posta dopo l'operatore.
Allora riscriviamo l'espressione per l'energia totale:
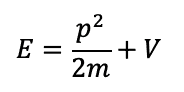
andando a sostituire gli operatori appena introdotti applicati alla funzione d'onda Ψ:
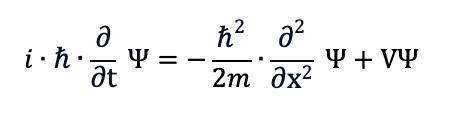
ottenendo quindi l'equazione di Schrodinger.
Ogni soluzione Ψ(x,y,z,t) dell'equazione di Schrodinger è chiamata funzione d'onda ed è composta da due componenti ognuna delle quali dipende dalle coordinate spaziali e temporali e che si indicano come Ψ1 e Ψ2.
In sostanza la funzione d'onda Ψ è una funzione a valori complessi che è composta da una parte reale Ψ1 e da una parte immaginaria Ψ2 e può essere scritta come:
Ψ = Ψ1 + i ⋅ Ψ2
Secondo la prospettiva di Schrödinger, l'elettrone nell'atomo di idrogeno non è descritto come un punto materiale, ma piuttosto la sua presenza è distribuita su una scala atomica in un volume relativamente esteso. In accordo con questo concetto, la funzione d'onda, indicata con Ψ(x,y,z,t), fornisce la densità elettronica nel punto di coordinate x, y e z al tempo t.
La "densità elettronica" si riferisce alla probabilità di trovare un elettrone in una specifica regione dello spazio in un dato istante di tempo. In termini più specifici, la densità elettronica è rappresentata dal modulo quadro della funzione d'onda di un elettrone ovvero da |Ψ|2. Il modulo quadro di una funzione complessa risulta essere una funzione reale e quindi rappresentabile facilmente nel piano: l'area sottesa da tale funzione rappresenta la probabilità di trovare la particella in quel particolare range.
La densità elettronica in un determinato punto dello spazio è quindi proporzionale al quadrato del modulo della funzione d'onda in quel punto.
In sostanza, la densità elettronica fornisce una rappresentazione della distribuzione probabile degli elettroni attorno al nucleo dell'atomo in un dato momento. Questo concetto è centrale nella teoria quantistica degli atomi.
Fu il fisico Max Born che per mantenere la descrizione dell'elettrone come un corpuscolo ha arricchito il lavoro di Schrödinger introducendo l'interpretazione basata su concetti probabilistici. Secondo Born, la funzione d'onda Ψ(x,y,z,t) rappresenta un'ampiezza di probabilità.
Questo implica che, se Ψ(x,y,z,t) descrive una particella, il quadrato del suo modulo |Ψ|2 rappresenta la densità di probabilità, o la probabilità per unità di volume, che la particella si trovi nelle vicinanze del punto (x, y, z) in un istante t specifico.
La descrizione della realtà fisica subisce un cambiamento sostanziale a causa della funzione d'onda: nella fisica classica possiamo determinare con certezza posizione e velocità di un punto materiale che si muove lungo una certa direzione invece nella fisica quantistica si utilizza la funzione d'onda lungo quella direzione e al tempo t per determinare la probabilità di osservare la particella in una certa zona all'istante fissato.
Esercizio
Considera la seguente funzione d'onda per una particella in una dimensione:
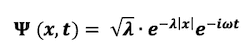
Calcolarne il modulo quadro, rappresentarlo graficamente ed interpretare dal grafico la probabilità di trovare la particella al di fuori dell'intervallo (<x>-σ; <x>+σ) in cui <x> rappresenta il valore atteso e σ la deviazione standard.
Lo svolgimento dell'esercizio lo trovi qui: quadrato del modulo di una funzione d'onda e probabilità di trovare la particella al di fuori di un certo intervallo.
Link correlati:
Enunciato e spiegazione delle modello atomico di Dalton
Modello atomico a panettone
Studia con noi