Atomo
Atomo: generalità, proprietà e definizione
In questa lezione vedremo che cos'è l'atomo e da quali particelle è composto. Vedremo le tappe che hanno portato alla scoperta di questa particella e cosa affermano i vari modelli atomici.
Definiremo l'unità di massa atomica, l'unità di misura adottata per quantificare la massa degli atomi.
Vedremo infine come è possibile conoscere il numero di protoni, elettroni e neutroni che compongono l'atomo.
Che cos'è l'atomo?
L'atomo è la più piccola parte di un elemento chimico che conserva le proprietà chimiche dell'elemento stesso.
Tutte le sostanze inorganiche e organiche, allo stato solido, liquido e gassoso esistenti in natura, sono formate da diverse combinazioni del centinaio di elementi, e quindi del centinaio di varietà di atomi, che esistono stabili in natura.
Le sostanze semplici, o elementi, sono costituiti da atomi della stessa specie; le sostanza composte, o composti, sono costituiti da atomi di specie diverse, ma sempre in rapporti numerici ben definiti e generalmente semplici.
Più atomi legati tra loro formano le molecole: queste ultime sono raggruppamenti di atomi con caratteristiche chimiche definite. Ogni molecola è rappresentata da una formula chimica (per esempio H2O per l'acqua e NH3 per l'ammoniaca) che specifica la tipologia e il numero di atomi che compongono la molecola.
Così, H2O significa che la molecola dell'acqua è formata da due atomi di idrogeno e da un unico atomo di ossigeno, viceversa, NH3 significa che la molecola dell'ammoniaca è formata da un atomo di azoto e da tre atomi di idrogeno.
Benché gli atomi siano troppo piccoli per essere osservati direttamente, gli studi dei chimici e dei fisici dei secoli XVIII e XIX hanno portato alle conclusioni - dette poc'anzi - sull'esistenza e sulle dimensioni degli atomi dei diversi elementi e hanno permesso di classificare gli atomi, a seconda della massa e del comportamento macroscopico nelle reazioni chimiche, in schemi organici fra i quali prevalse per completezza il sistema periodico di Mendeleev.
Gli studi degli ultimi cento anni hanno portato anche alla conoscenza della struttura interna degli atomi, non più pensabili, quindi, come le particelle indivisibili ipotizzate dai primi filosofi, ma costituiti da protoni, elettroni e neutroni (si veda in seguito).
Gli atomi sono particelle piccolissime, che si possono pensare come di forma sferica del diametro di alcuni Angstrom Å (1Å=10-10m).
Da quali particelle è costituito l'atomo?
L'atomo è costituito da elettroni (e−) che si muovono attorno a un nucleo composto (in uno schema molto semplificato) da protoni (p+) e neutroni (n0); nel nucleo è quasi del tutto concentrata la massa dell'atomo.
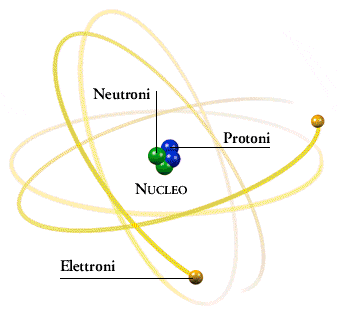
Struttura dell'atomo in un modello molto semplificato.
Il numero di protoni di un atomo corrisponde al numero atomico (Z) mentre la somma tra numero di protoni e numero di neutroni corrisponde al numero di massa (A); gli elettroni esterni al nucleo, sono invece numericamente uguali al numero di protoni.
Al simbolo chimico di un atomo (X) si associa spesso il numero A e, talvolta, anche Z secondo lo schema:
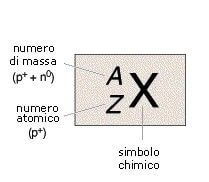
Ad esempio, 14C indica il carbonio (che ha Z = 6, valore che - come in questo caso - può essere omesso) e più precisamente l'isotopo 14, cioè con A = 14.
Si è trovato che sono principalmente le proprietà elettriche degli atomi, quindi il numero e la disposizione degli elettroni attorno al nucleo, che distinguono i diversi elementi chimici tra loro e fanno sì, per esempio, che un atomo di idrogeno 1H (un elettrone attorno a un protone) sia diverso da un atomo di ossigeno-16 (16O: otto elettroni, otto neutroni e otto protoni).
Esistono atomi (detti isotopi) con diversa massa ma uguale numero di elettroni (quindi varia solo il numero di neutroni) che chimicamente si comportano in maniera uguale: per esempio, l'ossigeno 18O, in cui vi sono due neutroni in più che nel 16O, non si può distinguere chimicamente da quest'ultimo.
L'atomo nella storia
Il concetto di atomo come particella indivisibile (da cui il nome, derivato dal greco) venne elaborato nell'antichità in ambito filosofico (Leucippo e Democrito, V-IV a.C.); assunse in seguito il carattere di ipotesi e poi di teoria scientifica con la scoperta delle leggi ponderali (fine XVIII secolo e inizi XIX secolo).
Nella seconda metà del XIX secolo, principalmente con J.C. Maxwell e L. Boltzmann, si sviluppa la teoria cinetica dei gas che, per la prima volta, interpreta fenomeni fisici macroscopici mediante semplicissime ipotesi sulla struttura atomica della materia.
La cristallografia induce a supporre che anche le proprietà dei solidi possano trovare una spiegazione nella loro struttura atomica, in questo caso perfettamente regolare.
Alla fine del secolo XIX le scoperte dell'elettrone e della radioattività aprono la via allo studio della struttura dell'atomo e del suo legame con la spettroscopia.
Agli inizi del XX secolo sono ormai tantissimi i fenomeni in cui l'atomo interviene come elemento essenziale. Per giustificarne altri, invece, nasce la teoria dei quanti e viene applicata alla struttura dell'atomo. Nascono in questi anni anche i primi modelli atomici.
Atomo e modelli atomici
I modelli atomici sono modelli studiati dall'uomo che ipotizzano la struttura dell'atomo. Il primo modello atomico (1904) fu quello proposto dal fisico britannico Sir Joseph John Thomson (Manchester, 18 dicembre 1856 – Cambridge, 30 agosto 1940).
Secondo questo modello atomico (modello atomico proposto di Thomson) gli elettroni carichi negativamente sono dispersi, come gli acini di uvetta in un panettone, in una massa elettricamente positiva, in modo da determinarne l'equilibrio delle cariche.
Il secondo modello atomico (1911) è il modello atomico proposto da E. Rutherford. Secondo questo modello l'atomo ha una struttura che ricorda quella del Sistema Solare: il Sole rappresenta il nucleo dell'atomo e i pianeti gli elettroni, che si muovono, lungo le proprie orbite attorno al Sole (nucleo dell'atomo).
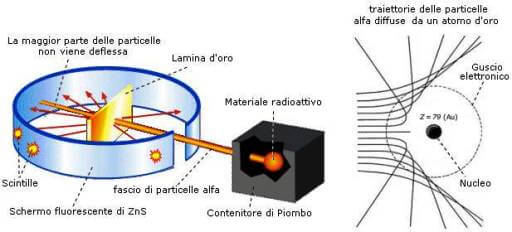
L'esperimento di Rutherford che sancisce la nascita del suo modello atomico.
Nel 1913, N. Bohr formulò il suo modello atomico noto come modello atomico di Bohr. Secondo questo modello atomico l'elettrone può percorrere attorno al nucleo alcune orbite circolari senza perdere energia.
L'eventuale energia assorbita da un elettrone ne consente la transizione dall'orbita in cui si trova normalmente (stato fondamentale) a una delle orbite di energia quantizzata superiore (stato eccitato).
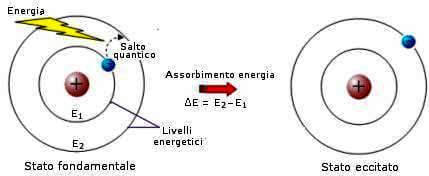
In queste orbite l'elettrone permane per un tempo brevissimo (dell'ordine dei nanosecondi), per poi ritornare allo stato energetico fondamentale.
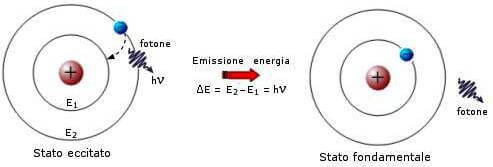
Via via questi modelli si sono ulteriormente raffinati per tenere conto di nuove scoperte, portando all'attuale concezione della struttura atomica rappresentata dal modello atomico a orbitali.
Massa dell'atomo
La massa di un atomo è detta massa atomica o, impropriamente, peso atomico. Dal 1960 è stata introdotta la scala unificata che assume come riferimento l'isotopo 12C del carbonio; ad esso è stato assegnato il valore 12.
In questa scala l'idrogeno vale 1,007825 uma, in cui uma è l'abbreviazione di unità di massa atomica, l'unità di misura per la determinazione delle masse atomiche.
Un uma corrisponde alla dodicesima parte della massa di un atomo di carbonio-12 (12C) e quindi a 1,66·10-27 kg.
La massa atomica di un atomo (massa atomica relativa) è determinata per confronto con l'unità di massa atomica; essa indica quante volte la massa di un atomo è maggiore rispetto a un dodicesimo della massa del 12C.
Quindi, per esempio, dire che l'atomo di sodio ha un massa atomica di 23 uma, significa che la massa dell'atomo di sodio è 23 volte maggiore rispetto a un dodicesimo della massa del carbonio-12 (ovvero 23 volte un uma).
Quiz sull'atomo
Se ti interessano li trovi qui: quiz sull'atomo.
Link correlati:
Quali sono le particelle dell'atomo?
Qual è la differenza tra atomo e molecola?
Che cosa sono gli ioni poliatomici?
Che cosa sono i protoni, gli elettroni e i neutroni?
Studia con noi