Sublimazione
Passaggi di stato: sublimazione
Per sublimazione si intende il passaggio di un corpo dallo stato solido allo stato aeriforme senza passare attraverso lo stato liquido; tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
Quando un solido può sublimare?
Anche i solidi, come i liquidi, possiedono una pressione di vapore che viene indicata come pressione di sublimazione e che varia con la temperatura secondo l'equazione di Clapeyron; nei solidi i valori delle pressioni di sublimazione sono nella gran parte dei casi estremamente piccoli poiché le energie di legame nei solidi sono, a parità di condizioni sperimentali, maggiori che nei liquidi.
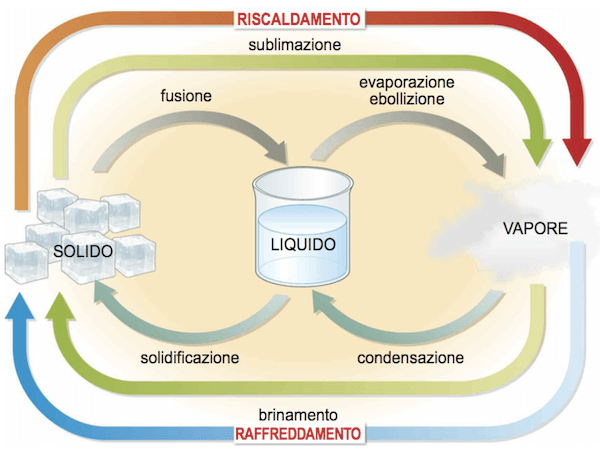
La sublimazione è il passaggio di una sostanza dalla fase solida alla fase di vapore.
Soltanto pochi solidi molecolari, nei quali i valori delle energie di legame fra le molecole sono modesti, possiedono una pressione di sublimazione apprezzabile anche a temperature non elevate.
In via teorica tutti i solidi sublimano; in pratica si dice che un solido sublima quando il passaggio solido → vapore avviene non troppo lentamente, cioè quando la pressione di sublimazione del solido è abbastanza elevata: così lo iodio alla temperatura di 110 °C ha una pressione di sublimazione di 80 mm Hg e pertanto se a detta temperatura la pressione di vapore dello iodio viene mantenuta inferiore ad 80 mm Hg (ad esempio condensando i vapori su una parete fredda se riscaldato in recipiente chiuso, oppure riscaldandolo in recipiente aperto da cui i vapori diffondono nell'atmosfera) lo iodio solido passa direttamente, e rapidamente, allo stato di vapore.
La sublimazione si verifica quindi in quelle sostanze nelle quali la tensione di vapore uguaglia il valore della pressione atmosferica prima di raggiungere la temperatura di fusione.
I solidi che sublimano (che, come già detto, sono tutti solidi molecolari con basse energie di legame), possono anche fondere purché durante il riscaldamento la pressione del loro vapore sia mantenuta costantemente superiore alla pressione di sublimazione: così lo iodio riscaldato in recipiente chiuso fonde a 113,7°C (temperatura alla quale la pressione di vapore saturo dello iodio vale circa 90 mmHg = 90 torr).
Il fenomeno della sublimazione dei solidi fa riscontro a quello della evaporazione dei liquidi; in ambedue i casi, infatti, molecole superficiali di una fase condensata passano allo stato di vapore.
Mentre però nella evaporazione dei liquidi può formarsi vapore anche all'interno della massa liquida (fenomeno dell'ebollizione), l'analogo fenomeno non si verifica nella sublimazione.
Ciò è dovuto al fatto che nei liquidi le molecole sono mobili e assoggettate a moti convettivi e il calore fornito dall'esterno viene rapidamente distribuito fra tutte le molecole che costituiscono la massa liquida.
Nei solidi invece le molecole superficiali che assorbono calore ne trasmettono solo una piccola parte all'interno del solido, e, se i legami fra le molecole del solido sono deboli, esse possono trovarsi ad avere energia sufficiente per passare direttamente dallo stato solido allo stato di vapore: nella sublimazione, quindi, il vapore si genera soltanto alla superficie, e non all'interno del solido.
Esempi di sostanze che sublimano
Esempi di sostanze che possono sublimare: iodio, naftalina, canfora, anidride carbonica solida (nota anche come ghiaccio secco).
Calore latente di sublimazione
Come si è detto in precedenza, il processo di sublimazione è di tipo endotermico e quindi richiede energia. Il calore necessario alla sublimazione di una mole di solido prende il nome di calore latente molare di sublimazione (λsub) la cui unità di misura, nel Sistema Internazionale, è J·mol-1.
Il calore latente molare di sublimazione (λsub) è uguale alla somma tra il calore latente molare di fusione (λf) e il calore latente molare di evaporazione (λv):
λsub = λf + λv
Noto λsub, il calore necessario per la sublimazione di n moli di sostanza è determinabile applicando la seguente formula:
Q = n · λsub
in cui:
λsub = calore latente molare di sublimazione (J/mol);
n = numero di moli (mol).
Impieghi della sublimazione
Il processo di sublimazione e successiva condensazione del vapore, analogo alla distillazione dei liquidi, viene spesso impiegato per separare una specie che sublima da altre specie che non sublimano.
In campo alimentare, invece, la sublimazione del ghiaccio è alla base del processo industriale di essiccazione chiamato liofilizzazione; essa trova vasto impiego anche nella industrie farmaceutiche.
Studia con noi