Evaporazione
Passaggi di stato: l'evaporazione
Per evaporazione si intende il passaggio di un corpo dallo stato liquido allo stato di vapore; tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
L'evaporazione è un processo che avviene solo alla superficie del liquido, è tanto più rapido quanto maggiore è la temperatura e si arresta soltanto quando tutto il liquido è evaporato.
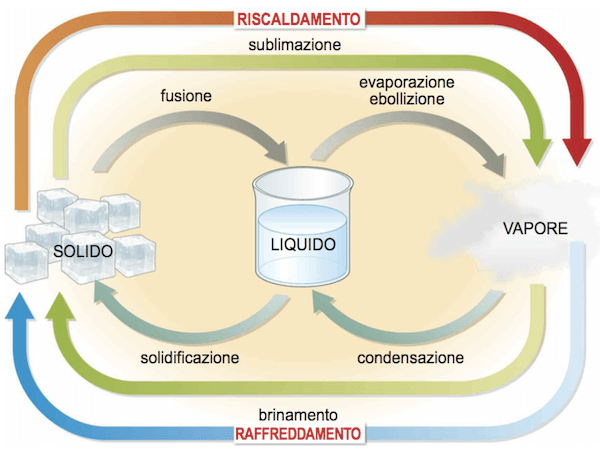
L'evaporazione è il passaggio di una sostanza dalla fase liquida alla fase di vapore.
La velocità con cui un liquido evapora dipende da vari fattori: chiaramente dalla temperatura (a 30°C l'acqua evapora più velocemente che a 10°C), dal tipo di liquido considerato (l'alcol etilico evapora più velocemente dell'acqua) ma anche dall'area della superficie sulla quale avviene l'evaporazione e dalla ventilazione della superficie ovvero dalla velocità con cui la superficie del liquido possa essere resa libera dalle molecole evaporate.
Differenza tra evaporazione ed ebollizione
L'evaporazione non è da confondere con l'ebollizione. L'evaporazione è il passaggio di un liquido a vapore; tale trasformazione avviene per temperature inferiori a quella di ebollizione e interessa soltanto le molecole distribuite sulla superficie libera del liquido.
L'ebollizione invece avviene ad una temperatura caratteristica (il cui valore dipende dalla pressione esterna) detta temperatura di ebollizione; si ha il passaggio tumultuoso del liquido a vapore con formazione di bolle all'interno della massa del liquido.
Inoltre, per un determinato valore della pressione esterna, l'evaporazione avviene a qualsiasi temperatura, mentre l'ebollizione avviene solo ad una determinata temperatura detta appunto temperatura di ebollizione.
Pertanto, un liquido inizialmente evapora; aumentando la temperatura, il valore della pressione di vapore saturo eguaglia la pressione ambiente e l'evaporazione si trasforma in ebollizione con la formazione di bolle di vapore anche all'interno della massa liquida.
Spiegazione del fenomeno dell'evaporazione da un punto di vista microscopico
Un liquido è costituito da particelle in moto che, in funzione della temperatura, hanno una determinata energia cinetica media.
In un dato istante esisteranno però particelle con energia cinetica maggiore e particelle con energia cinetica minore dell'energia cinetica media, in conseguenza della distribuzione statistica dell'energia cinetica delle particelle di Maxwell e Boltzmann.
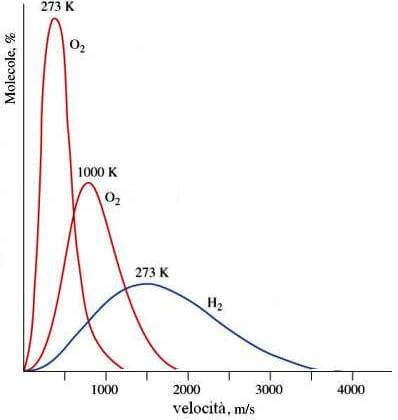
Distribuzione statistica dell'energia cinetica delle particelle (Maxwell-Boltzmann).
Le particelle più energetiche che si trovano, in un dato istante, alla superficie del liquido, avranno sufficiente energia per sottrarsi all'azione attrattiva delle altre particelle e di passare allo stato di vapore: in altre parole si allontanano dalla massa di liquido di cui fanno parte.
Se immaginiamo di seguire una determinata particella del liquido, essa collide continuamente con le altre particelle e di conseguenza, istante per istante, può aumentare, diminuire o mantenere costante la sua energia cinetica.
Se ad un certo istante questa molecola si trova alla superficie del liquido e possiede in quell'istante energia sufficientemente elevata da vincere l'azione attrattiva delle altre particelle, si allontana dal liquido e passa nella fase vapore: in questo modo si ha l'evaporazione delle particelle del liquido.
Anche nella fase di vapore la particela continua a collidere con le altre molecole presenti in questa fase e anche qui può, di nuovo, aumentare, diminuire o mantenere costante la propria energia cinetica. Nei suoi movimenti potrà succedere che impatta la superficie della fase liquida e se in quell'instante possiederà un adatto valore di energia, rientrerà a fare parte della fase liquida.
Evaporazione e curva di riscaldamento
In una curva di riscaldamento, come quella di seguito riportata relativa all'acqua distillata, il fenomeno dell'evaporazione avviene nel tratto C-D della curva. Infatti C è il punto corrispondete al termine della fusione; nel punto C tutto il ghiaccio si è trasformato in liquido. Nel punto D invece si ha l'inizio del processo di ebollizione. Per far passare l'acqua dal punto C al punto D bisogna chiaramente somministrare calore.
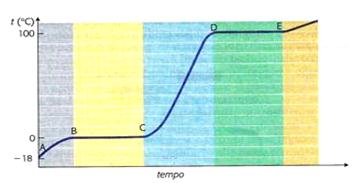
Curva di riscaldamento dell'acqua distillata alla pressione di 1 atm.
Calore latente di evaporazione
Come si è detto, il processo di evaporazione è di tipo endotermico e quindi richiede energia. Il calore necessario alla evaporazione di una mole di liquido prende il nome di calore latente molare di evaporazione (λv) la cui unità di misura, nel Sistema Internazionale, è J·mol-1.
Noto λv, il calore necessario per la vaporizzazione di n moli di sostanza è determinabile applicando la seguente formula:
Q = n ·λv
in cui:
λv = calore latente molare di vaporizzazione (J/mol);
n = numero di moli (mol).
Link correlati:
Qual è la differenza tra evaporazione ed ebollizione?
Studia con noi