Spettroscopia
Principio di funzionamento della spettroscopia
La spettroscopia è un ramo della chimica che studia gli spettri degli atomi e delle molecole, cioè la distribuzione, in funzione della frequenza (v), della lunghezza d'onda (λ) o del numero d'onda (cioè il numero di lunghezze d'onda della radiazione considerata comprese in un centimetro) dell'energia elettromagnetica emessa o assorbita da atomi e molecole.
Le singole lunghezze d'onda sono separate mediante rifrazione in prismi trasparenti, diffrazione da reticoli o, diffrazione da solidi cristallini.
Gli strumenti designati a questo scopo prendono il nome di spettroscopi, spettrografi, spettrometri o spettrofotometri secondo i casi.
Nata come spettroscopia ottica, cioè come studio della distribuzione dell'energia nell'intervallo delle radiazioni percepibili all'occhio umano (quando ancora non era chiara la natura elettromagnetica di tali radiazioni), si è allargata a comprendere lo studio dell'intero spettro elettromagnetico, dalle onde radio ai raggi γ proprio in virtù dello sviluppo della teoria elettromagnetica che dimostrò l'identità sostanziale di tutte queste onde.
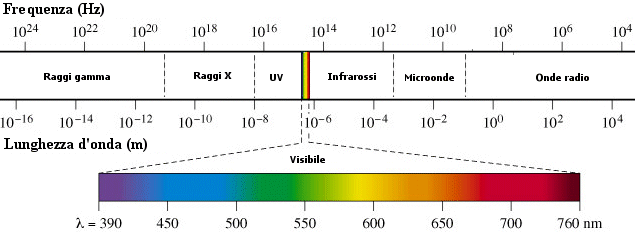
Spettro elettromagnetico.
Nell'accezione più moderna il termine comprende anche lo studio di quelle radiazioni corpuscolari (ad esempio fotoelettroni) che possono essere emesse da un corpo eccitato da una radiazione elettromagnetica o corpuscolare.
Suddivisione in campi di lunghezza d'onda
La spettroscopia si suddivide in diverse branche secondo i metodi usati per produrre e rivelare le radiazioni elettromagnetiche studiate: il criterio comunemente accettato si basa sulla lunghezza d'onda delle radiazioni in esame.
Si ha così la spettroscopia dei raggi X, dell'ultravioletto, del visibile, dell'infrarosso, delle microonde e delle radioonde, in ordine di lunghezza d'onda crescente, ciascuna delle quali trova campi di applicazione diversi.
Ad esempio, la spettroscopia dei raggi X viene impiegata nello studio degli strati elettronici più interni degli atomi (tra cui avvengono le transizioni energetiche che danno luogo agli spettri a righe dei raggi X), è l'analisi chimica per fluorescenza, mediante la quale si riesce ad analizzare quantitativamente leghe metalliche o composti chimici, mentre la spettroscopia del visibile trova applicazioni nello studio della configurazione elettronica esterna degli atomi.
Strumentazione usata per gli studi spettroscopici
La strumentazione usata per gli studi spettroscopici è costituita sostanzialmente dagli spettroscopi, dagli spettrometri, dagli spettrografi, dagli interferometri e dagli spettrofotometri.
- Interferometri
Per il loro principio di funzionamento, che consente di rivelare differenze di cammino ottico di frazioni di una lunghezza d'onda, gli interferometri sono potenti strumenti ausiliari nella spettroscopia ad alta risoluzione e nella misura assoluta delle lunghezze d'onda.
- Spettrometri e spettrofotometri
Quando lo spettroscopio sia fornito di una scala che consente la lettura diretta della lunghezza d'onda della radiazione in esame, esso prende il nome di spettrometro; si chiamano invece spettrofotometri gli strumenti particolarmente studiati per misurare la distribuzione dell'intensità delle radiazioni in funzione della lunghezza d'onda.
Tra i due termini c'è tuttavia una certa sovrapposizione nell'uso, in quanto si preferisce riservare il nome di spettrofotometri agli strumenti che funzionano in assorbimento, mentre si dà il nome di spettrometri a quegli spettrofotometri in cui viene rilevata l'intensità di un certo numero di righe di emissione.
Nell'uno e nell'altro tipo di strumento il rivelatore è di solito di tipo fotoelettrico, fotoconduttivo, bolometrico o radiometrico: tuttavia, mentre in generale gli spettrofotometri ad assorbimento presentano le misure sotto forma di un diagramma continuo dell'intensità in un certo campo di lunghezze d'onda, gli spettrometri danno in genere l'intensità di una o più righe discrete che vengono selezionate dallo spettro mediante fenditure e focalizzate sui rivelatori.
Identificazione delle righe spettrali
L'identificazione di una riga spettrale, per quanto concerne la sua origine fisica o chimica, avviene principalmente mediante la misura della sua lunghezza d'onda, che è la sua proprietà più accuratamente misurabile.
Se gli spettri atomici e ionici di una settantina di elementi chimici fossero riportati su un unico spettrogramma, questo conterebbe circa 500.000 righe con una separazione media di circa 0,0014 nm: sembrerebbe quindi che l'identificazione di una riga spettrale sia cosa impossibile.
Fortunatamente, quando un elemento è diluito in un altro, esso presenta uno spettro semplificato e, al limite, una sola riga quale traccia spettroscopica. Inoltre, un campione per analisi spettrochimica difficilmente contiene più di 12-24 elementi chimici.
Un secondo criterio per identificare la natura fisico-chimica di una riga è rappresentata dalla misura dell'intensità luminosa relativa della riga rispetto ad altre presenti nello spettro: ad esempio, per il sodio l'intensità della riga a 589,592 nm è doppia di quella a 588,995 nm.
La misura di intensità non può, purtroppo, essere fatta con la stessa precisione di quella di lunghezza d'onda; tuttavia sono note con buona approssimazione le intensità relative di parecchie migliaia di righe spettrali.
Gli spettri delle fasi condensate (liquidi e solidi) sono caratterizzati da bande di assorbimento o emissione. In tal caso, oltre alla lunghezza d'onda del picco della banda e all'intensità totale, elementi importanti per l'identificazione sono anche la forma e la semilarghezza della banda stessa.
Interpretazione degli spettri
Per procedere all'interpretazione di uno spettro è necessario disporre di un certo numero di misure concernenti le righe spettrali. Tali misure sono:
- determinazione della lunghezza d'onda,
- misura dell'intensità relativa o assoluta di due o più righe,
- misura della larghezza di riga,
- misura del profilo della riga o della banda,
- rilievo delle strutture fine e iperfine.
In base a tali misure è possibile:
1) identificare qualitativamente e determinare quantitativamente un elemento chimico;
2) dedurre la struttura microscopica degli atomi, delle molecole e delle fasi condensate;
3) valutare proprietà intrinseche dei nuclei atomici, una volta risolte le strutture iperfine.
Link correlati:
Esercizi online e gratuiti sulla spettrofotometri UV-VIS
Esercizi svolti e online sulla spettrofotometria di assorbimento atomico
Come funziona una lampada a catodo cavo?
Esercizio svolto e commentato sul calcolo dell'assorbanza e della trasmittanza percentuale
Esercizio sulla spettrofotometria UV-Vis e il metodo della retta di taratura
Esercizio sulla spettrofotometria UV-VIS e il reattivo di Griess
Spiegazione dello spettro dell'atomo di idrogeno
Studia con noi