Spettro dell'idrogeno
Spiegazione dello spettro dell'atomo di idrogeno
Gli spettri atomici sono spettri di assorbimento o spettri di emissione relativi all'atomo di idrogeno.
Ciascuna riga spettrale viene associata a una transizione quantica di un elettrone da un livello energetico a un altro; ogni transizione è a sua volta associata all'emissione o all'assorbimento di radiazione elettromagnetica di frequenza corrispondente alla differenza di energia tra i due livelli interessati alla transizione.
Essendo discreti i livelli energetici degli atomi, anche le frequenze sono discrete e si manifestano in forma di righe sottili. Le righe, e quindi le frequenze corrispondenti, sono usualmente ben risolte solo nel caso di atomi allo stato gassoso. In tale stato, infatti, gli atomi possono essere considerati ben lontani l'uno dall'altro e non si ha quindi nessuna sensibile interazione che possa perturbare i livelli energetici e quindi la frequenza delle righe.
Spettro dell'atomo di idrogeno
Il più semplice spettro a righe è quello dell'atomo d'idrogeno: nel visibile e nell'ultravioletto vicino esso è costituito da un numero relativamente piccolo di righe, le cui mutue distanze e intensità decrescono in maniera regolare verso le lunghezze d'onda minori.
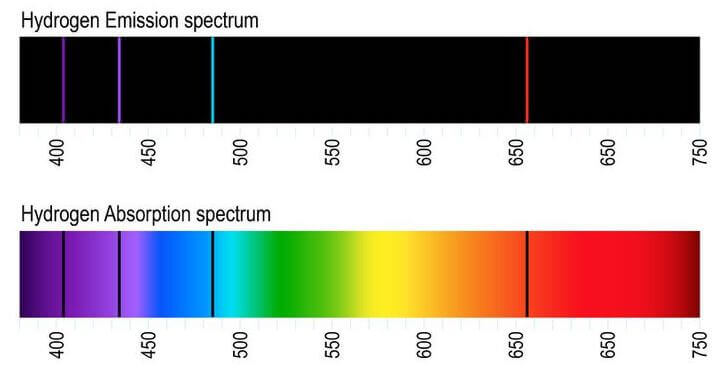
Spettro di emissione (in alto) e spettro di assorbimento (in basso) dell'atomo di idrogeno. Le righe nere nello spettro di assorbimento coincidono con le righe colorate dello spettro di emissione. Quindi l'idrogeno (così come le altre sostanze) assorbe radiazioni luminose della stessa lunghezza d'onda e frequenza di quelle che è in grado di emettere.
Le righe spettrali dell'atomo di idrogeno possono essere raggruppate in "serie" descrivibili in prima approssimazione mediante la formula (detta di formula di Balmer) che dà il numero d'onda ![]() = 1/λ (λ viene cioè definito come l'inverso della lunghezza d'onda misurata in cm e quindi viene espresso in cm-1) di ciascuna riga, in esse contenuta:
= 1/λ (λ viene cioè definito come l'inverso della lunghezza d'onda misurata in cm e quindi viene espresso in cm-1) di ciascuna riga, in esse contenuta:
![]()
dove R è la costante di Rydberg per l'idrogeno (≃ 109.678 cm-1) mentre n e m sono due numeri interi. Ogni serie corrisponde a un valore costante di n mentre m può assumere tutti i valori interi maggiori di n.
Nel visibile è presente la sola serie di Balmer (n = 2); la sua prima riga (m = 3) è la linea rossa con λ = 656,3 nm, che si indica anche con Hα, mentre le successive righe (Hβ, Hγ, ecc.) procedono verso il violetto con spaziatura e intensità in diminuzione e convergono al valore λ = 364,6 nm che costituisce il limite della serie; esso corrisponde al valore m = ∞ e il suo numero d'onda è quindi dato da ![]() = R / 22 = R /4; di là da questo limite si ha lo spettro continuo.
= R / 22 = R /4; di là da questo limite si ha lo spettro continuo.
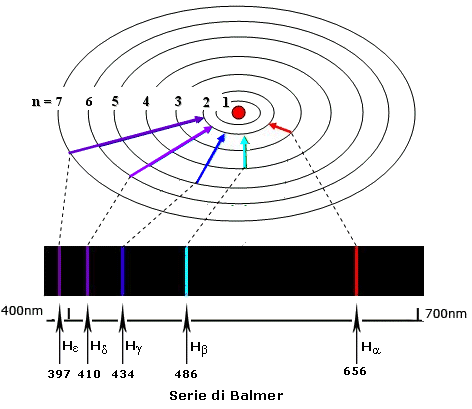
Le altre serie (n = 1, 3, 4 ...) corrispondono a radiazioni non comprese nello spettro visibile: la serie di Lyman (n = 1) nell'ultravioletto lontano (λ da 121,5 a 91,2 nm), la serie di Paschen (n = 3) nell'infrarosso (λ da 1875,1 a 820,6 nm) e, sempre nell'infrarosso, le serie di Brackett (n = 4) e di Pfund (n = 5).
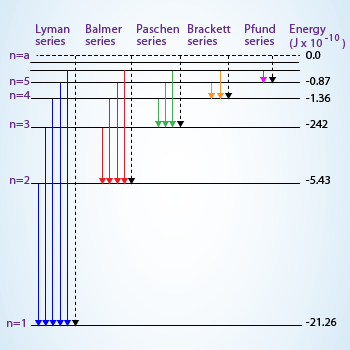
Diagramma dei termini spettrali
Per collegare lo spettro dell'idrogeno alla sua struttura atomica è opportuno riferirsi al corrispondente diagramma dei termini spettrali (figura seguente). Nell'atomo d'idrogeno si dà il nome di "termine spettrale" alle quantità R/n2 che si ottengono dividendo la costante di Rydberg per 1, 4, 9, ... , e che sono riportate nel diagramma come linee orizzontali; il termine con n = ∞ è il più alto e con esso comincia il continuo dei livelli corrispondenti a stati ionizzati.
Ciascun termine spettrale rappresenta anche un livello energetico dell'atomo e l'energia di ogni livello si ottiene esprimendo il corrispondente numero d'onda in elettronvolt (1 eV = 8066 cm-1); secondo le convenzioni spettroscopiche il termine più alto (n = ∞) ha energia nulla, tutti gli altri hanno energia negativa e crescente in valore assoluto verso il basso.
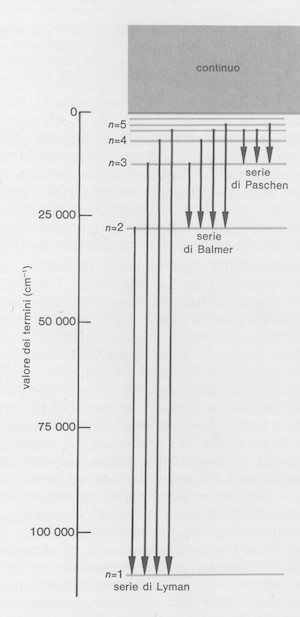
Diagramma dei termini spettrali dell'atomo di idrogeno.
Dal punto di vista della struttura atomica, i termini spettrali sono molto più importanti delle stesse righe spettroscopiche poiché queste ultime possono essere facilmente derivate da quelli; inoltre i termini sono in numero molto minore di quello delle righe.
Ogni riga è rappresentata da una freccia o una linea verticale che unisce due livelli e la differenza fra i termini corrispondenti dà il numero d'onda della riga. Il livello energetico più alto corrisponde alla ionizzazione dell'atomo d'idrogeno, cioè alla separazione dell'atomo nei due componenti (nucleo atomico ed elettrone) a distanza infinita e in quiete; al di sopra di questo c'è un continuo di stati rappresentanti il nucleo più un elettrone libero e dotato di energia cinetica arbitraria. Il livello più basso corrisponde invece allo stato fondamentale dell'atomo e all'energia minima necessaria per ionizzare l'atomo; questa energia (13,59 eV = 109.617 cm-1) è detta energia di ionizzazione.
Link correlati:
Qual è la differenza tra uno spettro continuo e uno spettro a righe?
Studia con noi