Molecola apolare
Quando una molecola è apolare?
Un dipolo si forma quando due cariche di uguale intensità ma di segno opposto sono collocate a una certa distanza r: il più semplice dipolo elettrico è costituito da due cariche elettriche uguali +Q e -Q a distanza r.
Al dipolo è associato un certo momento di dipolo (µ) dato dal prodotto tra l'intensità di carica Q e la distanza r:
![]()
Il momento di dipolo può essere rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo.
Molecole apolari
Sono dette apolari (= non polari) le molecole che presentano un momento di dipolo totale (dovuto alla dislocazione delle cariche elettriche nella molecola) uguale a zero.
Sono molecole apolari:
- tutte le molecole biatomiche omonucleari (cioè costituite da soli due atomi identici tra loro; esempio: O2, N2, H2, Cl2, ecc.);
- tutte le molecole (biatomiche o poliatomiche) costituite da soli legami covalenti non polari;
- tutte le molecole poliatomiche che presentano più legami covalenti polari, nelle quali i momenti di dipolo associati ai singoli legami covalenti polari si annullano tra loro.
Infatti, in una molecola poliatomica, i dipoli associati a ogni singolo legame covalente polare possono essere rappresentati con dei vettori. La somma dei vettori determina il dipolo totale associato alla molecola: se la somma vettoriale dei vettori associati a ogni singolo legame covalente polare è nulla, allora la molecola è apolare.
Ti potrebbe interessare: molecole polari.
Pertanto, se una molecola presenta legami covalenti polari non significa che debba essere per forza polare: la polarità della molecola dipende, infatti, anche dalla sua geometria.
Molecole apolari: il caso della molecola dell'anidride carbonica
La formula chimica dell'anidride carbonica è CO2: l'atomo di carbonio lega i due atomi di ossigeno mediante due legami covalenti doppi (O=C=O).
L'atomo di ossigeno, avendo una elettronegatività maggiore di quella del carbonio, assume una parziale carica negativa (δ−), mentre l'atomo di carbonio assume una parziale carica positiva (δ+, o meglio 2δ+).
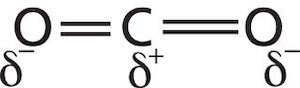
Ogni singolo legame covalente polare può essere pertanto rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo (e quindi verso l'atomo di ossigeno).
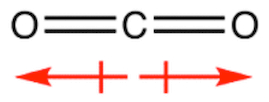
Siccome la molecola dell'anidride carbonica è lineare (l'angolo O-C-O risulta essere di 180°), possiamo asserire che la molecola è apolare in quanto i momenti di dipolo associati ai legami covalenti polari si annullano tra di loro.
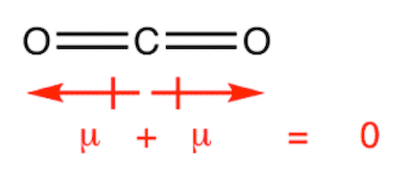
La molecola dell'anidride carbonica è apolare: è infatti costituita da due legami covalenti polari ma i dipoli associati ai due legami covalenti sono disposti in maniera tale da annullarsi.
Molecole apolari: il caso della molecola del tetracloruro di carbonio
Il tetracloruro di carbonio è un composto organico con formula chimica CCl4. L'atomo di carbonio lega i quattro atomi di cloro mediante quattro legami covalenti polari.
Gli atomi di cloro, avendo una elettronegatività maggiore di quella del carbonio, assumono una parziale carica negativa (δ−), mentre il carbonio assume una parziale carica positiva (δ+, o meglio 4δ+).
Secondo la teoria VSEPR, e in base ad evidenze sperimentali, sappiamo che la molecola del tetracloruro di carbonio ha geometria tetraedrica, in cui il carbonio si posiziona al centro e gli atomi di cloro occupano i vertici del tetraedro.
Risulta quindi che, grazie alla simmetria della molecola, i quattro momenti di dipolo associati ai quattro legami covalenti polari si annullano tra loro: la molecola del CCl4 è pertanto apolare.
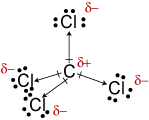
La molecola del tetracloruro di carbonio è apolare: è infatti costituita da quattro legami covalenti polari ma i momenti di dipolo associati ai quattro legami covalenti sono disposti in maniera tale da annullarsi.
Molecole apolari: il caso della molecola del metano
Stessa identica cosa succede con la molecola del metano. La molecola del metano è tetraedrica e apolare: è infatti costituita da quattro legami covalenti polari ma i momenti di dipolo associati ai quattro legami covalenti sono disposti in maniera tale da annullarsi.

La molecola del metano è apolare: si noti che i momenti di dipolo associati ai quattro legami covalenti polari puntano verso l'atomo di carbonio più elettronegativo.
Quando le molecole (che presentano legami covalenti polari) sono apolari?
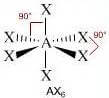
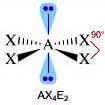
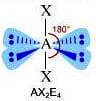
Come si è visto riguardo alla teoria VSEPR, ogni molecola può essere rappresentata con la formula generica AXmEn in cui:
- A = atomo centrale
- X = atomi legati all'atomo centrale
- E = coppie di elettroni solitarie presenti sull'atomo centrale
Supponiamo che gli atomi X legati all'atomo centrale A siano identici e che il legame tra A e X sia di tipo covalente polare. La molecola AXmEn è apolare se assume le seguenti geometrie molecolari:
NS = 2
X—A—X
NS = 3
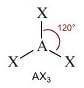
NS = 4
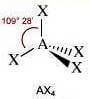
NS = 5
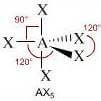
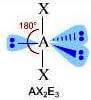
NS = 6
Link correlati:
Quali sono le proprietà solventi dell'acqua?
Studia con noi