Geometria delle Molecole
Previsione della geometria delle molecole
I legami covalenti sono legami direzionali e pertanto possono formare tra loro angoli caratteristici che determinano la forma e quindi la geometria della molecola.
La geometria di una molecola può essere prevista applicando la teoria VSEPR, (VSEPR è acronimo della denominazione inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie di elettroni del guscio di valenza).
Tale teoria permette di prevedere la geometria molecolare delle sostanze a partire dalle formule di Lewis.
Molte proprietà delle sostanza dipendono dalla geometria delle molecole che la compongono.
L'odore e il sapore dei cibi ad esempio sono causati dalla forma delle loro molecole, ma anche la polarità, il punto di fusione e il punto di ebollizione sono proprietà che dipendono dalla geometria molecolare.
Nello studio di questo argomento è consigliato l'utilizzo di kit per modellini molecolari necessari per comprendere la struttura e la geometria delle molecole. Vi rimandiamo al link per un eventuale acquisto del prodotto.
La teoria VSEPR in breve
Per un trattazione più approfondita vi rimandiamo alla seguente dispensa: teoria VSEPR. Qui di seguito tale teoria verrà descritta solo superficialmente.
I doppietti elettronici più esterni (strato di valenza) di un atomo, essendo carichi negativamente, tendono a respingersi e a disporsi il più lontano possibile gli uni dagli altri. In tale modo viene resa minima la forza repulsiva tra questi doppietti e la molecola risulta quindi più stabile.
La teoria prevede inoltre che le coppie di elettroni solitarie (non impegnate in legami) tendano ad occupare un volume maggiore rispetto alle coppie di elettroni condivise (cioè quelle coinvolte nei legami chimici) ed esercitino pertanto una forza repulsiva maggiore.
In prima approssimazione la forza repulsiva tra coppie di elettroni varia nel seguente modo:
repulsione tra doppietti solitari > repulsione tra doppietti solitari e doppietti condivisi > repulsione tra doppietti condivisi
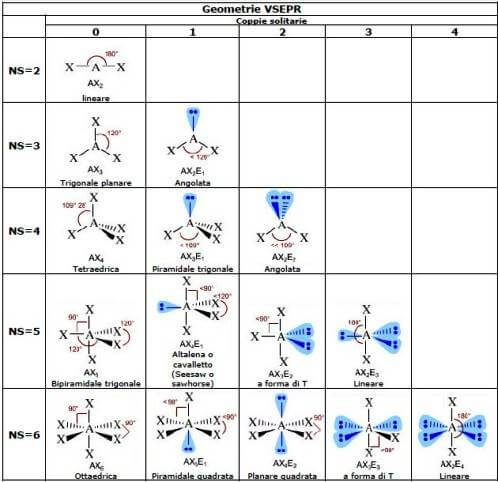
Inoltre secondo la teoria VSEPR la geometria di una molecola dipende unicamente dalla somma tra il numero di legami (indifferentemente dal fatto che siano semplici, doppi o tripli) e le coppie solitarie presenti nell'atomo centrale.
Ogni molecola può essere rappresentata con la formula generica AXnEm in cui con A rappresentiamo l'atomo centrale, X il numero di atomi legati all'atomo centrale ed E le coppie di elettroni solitarie presenti sull'atomo centrale.
Secondo la teoria VSEPR, per determinare la geometria di una molecola bisogna calcolare il valore del numero sterico NS eseguendo la somma tra (m + n); in altre parole è necessario determinare il valore del numero sterico NS sommando il numero di atomi (X) legati all'atomo centrale (A) e il numero di coppie di elettroni libere presenti sull'atomo centrale. In base a questo valore è possibile prevedere la geometria della molecola.

Di seguito sono rappresentate le possibili geometrie molecolari suddivise in base al valore del numero sterico NS e al numero di coppie solitarie presenti sull'atomo centrale:
Esercizi sulla geometria delle molecole
Esercizi sulla teoria VSEPR e sulla geometria delle molecole li trovi al seguente link: esercizi sulla teoria VSEPR.
Link correlati:
Che cos'è l'ibridazione sp3 del carbonio?
Quando una molecola è polare?
Studia con noi