Come si assegna il numero di ossidazione nei composti organici
Reazioni redox in chimica organica
Le reazioni redox (o reazioni di ossido-riduzione) sono reazioni nelle quali si ha uno scambio di elettroni tra due specie chimiche; una specie subisce una reazione di ossidazione, l'altra specie subisce una reazione di riduzione.
In chimica organica le reazioni di ossido-riduzione interessano essenzialmente l'atomo di carbonio e ne modificano lo stato di ossidazione.
Nei composti organici l'atomo di carbonio può assumere tutti i numeri di ossidazione compresi tra -4 e +4.
Attribuire i numeri di ossidazione ai vari atomi di carbonio di un composto organico non è una cosa particolarmente difficile; in tal senso è possibile determinare il valore medio del numero di ossidazione dell'atomo di carbonio in un composto organico ma, non bisogna dimenticarsi, che i diversi atomi di carbonio all'interno del composto possono avere numeri di ossidazione anche diversi.
Come assegnare il numero di ossidazione nei composti organici
Per l'attribuzione dei numeri di ossidazione nei composti organici si seguono le stesse regole viste per l'attribuzione del numero di ossidazione nei composti inorganici.
Consideriamo alcuni esempi.
Nell'etanolo CH3CH2OH sono presenti sei atomi di idrogeno (ciascuno dei quali ha numero di ossidazione nox = +1); un atomo di ossigeno (nox =-2) e due atomi di carbonio (nox = ?). Ricordando che in un composto neutro la somma dei numeri di ossidazione deve essere uguale a zero, si ha che:
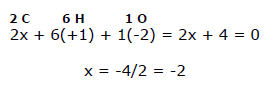
Pertanto il valore medio del numero di ossidazione di ciascun atomo di carbonio è -2.
Nell'etene sono presenti quattro atomi di idrogeno (ciascuno dei quali ha nox = +1) e due atomi di carbonio (nox = ?). In questo caso si ha che:
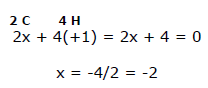
Anche in questo caso il valore medio del numero di osidazione di ciascun atomo di carbonio è -2.
I valori appena trovati sono però valori medi in quanto i diversi atomi di carbonio all'interno delle molecole possono assumere numeri di ossidazione anche diversi.
Volendo assegnare a ciascun atomo di carbonio il proprio numero di ossidazione, bisogna procedere in modo diverso.
Bisogna innanzitutto disegnare la struttura di Lewis.
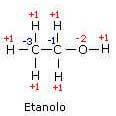
Nel caso dell'etanolo il legame tra gli atomi di carbonio è covalente puro (infatti la differenza di elettronegatività tra i due atomi è zero) e quindi gli elettroni di legame non vengono assegnati a nessuno dei due atomi.
Il carbonio metilico essendo più elettronegativo dell'atomo di idrogeno riceve tre elettroni dai tre atomi di idrogeno ad esso legati e pertanto assume numero di ossidazione -3.
L'altro atomo di carbonio assume invece numero di ossidazione -1 in quanto i due atomi di H contribuiscono in totale con una carica formale -2 (ciascun atomo di idrogeno cede il proprio elettrone al carbonio) mentre l'atomo di ossigeno contribuisce con una carica formale +1 (in questo caso è il carbonio che cede il proprio elettrone all'ossigeno).
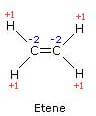
Nel caso dell'etene gli elettroni del doppio legame non vengono assegnati a nessuno dei due atomi mentre ciascun atomo di carbonio riceve due elettroni dagli atomi di idrogeno ad esso legato.
Pertanto il numero di ossidazione di ciascun atomo di carbonio è -2, mentre il numero di ossidazione di ciascun atomo di idrogeno è +1.
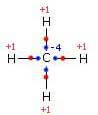
Nella molecola del metano l'atomo di carbonio essendo più elettronegativo dell'idrogeno, attira a sé gli elettroni messi in condivisione nel legame covalente ed assume numero di ossidazione -4. Ciascun atomo di H assume numero di ossidazione +1.
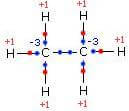
Nella molecola dell'etano il legame tra gli atomi di carbonio è covalente puro e quindi tra i due atomi di carbonio non c'è attribuzione del numero di ossidazione. Ciascun atomo di carbonio però riceve tre elettroni da tre atomi di idrogeno pertanto assume numero di ossidazione -3. Ciascun atomo di H assume invece numero di ossidazione +1.
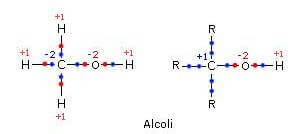
Un atomo di carbonio alcolico può avere numero di ossidazione compreso tra -2 e +1 a seconda del numero di gruppi alchilici ad esso legati (gli elettroni del legame tra l'atomo di carbonio e il gruppo alchilico non vengono assegnati a nessuno dei due atomi).
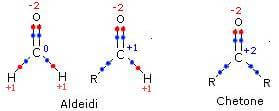
Il carbonio di una aldeide può avere numero di ossidazione 0 o +1, mentre quello di un chetone ha numero di ossidazione +2.
Il carbonio carbossilico può assumere numero di ossidazione +2 o +3.
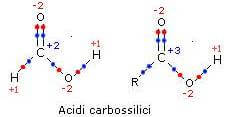
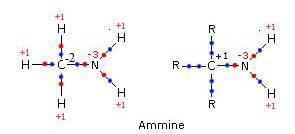
L'azoto amminico assume numero di ossidazione -3.
Studia con noi