Alfa elica (α-elica)
Struttura secondaria delle proteine: l'alfa elica (α-elica)
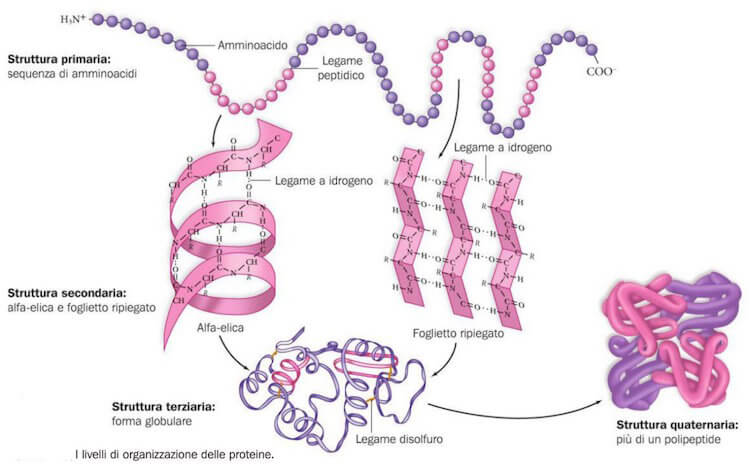
Immaginiamo di seguire al rallentatore le fasi dell'organizzazione tridimensionale della struttura primaria di una proteina.
La catena principale si ripiega progressivamente in modo da formare il maggior numero di legami a idrogeno tra il gruppo carbonilico e il gruppo -NH- dei legami peptidici.
I ripiegamenti della struttura proteica, dovuti alla formazione di questi legami a idrogeno, porta alla nascita della struttura secondaria della proteina.
La tecnica dei raggi X è stata utilizzata nel delucidare le due principali maniere secondo cui la struttura primaria di una proteina può interagire con se stessa nella formazione della struttura secondaria.
Una di queste due, ed è quella che studieremo in questa sezione, è nota con il nome di alfa elica (α-elica).
Formazione dell'alfa-elica
L'alfa-elica è dovuta ad una disposizione elicoidale delle unità peptidiche dell'intera molecola proteica o solo di alcune sue parti.
In essa, ciascun gruppo ammidico è legato con legami a idrogeno al gruppo ammidico che lo segue al terzo posto in ciascuna direzione lungo la catena. Vi sono quindi 3,6 unità di amminoacido per ogni giro dell'elica.
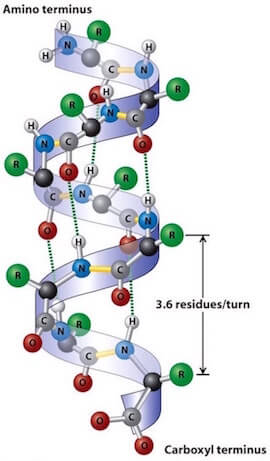
Benché i singoli legami a idrogeno siano abbastanza deboli, la formazione della alfa-elica (α-elica) è favorita dal fatto che essi sono presenti in grandi quantità e quindi, complessivamente, contribuiscono in modo significativo alla sua stabilità.
Le catene laterali (rappresentate nella figura con la lettera R) si estendono al di fuori rispetto all'asse dell'elica, risultando, in questo modo, distanti tra loro.
È per questo motivo che tale struttura si trova di preferenza in proteine o tratti di proteine con residui R voluminosi.
Tutti gli amminoacidi naturali hanno a configurazione L e fino a oggi tutte le eliche proteiche che si sono studiate hanno mostrato una disposizione destrorsa.
Questa disposizione a elica è molto comune nelle proteine; un esempio estremo è la proteina che trasporta l'ossigeno, che si chiama emoglobina in cui circa il 75% è sotto forma di α-elica.
Prolina ed alfa-elica
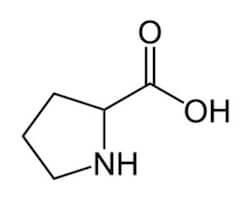
La natura ciclica dell'amminoacido prolina costringe il gruppo carbonilico, che è unito all'azoto della prolina, ad assumere una disposizione diversa da quella necessaria per la formazione dell'alfa-elica (a differenza di tutti gli altri amminoacidi che invece possono disporsi in modo adeguato).
Per questo, numerose proteine sono strutturate in segmenti elicoidali di una certa lunghezza, interrotti di tanto in tanto da tratti in cui l'elica "gira attorno ad un angolo".
Questo si verifica, in genere, laddove si trova lungo la catena un residuo della prolina nella sequenza degli amminoacidi.
Prolina
Nella maggior parte delle proteine vi sono anche delle zone in cui gli amminoacidi hanno una disposizione che non può essere descritta in alcun modo semplice.
L'altro tipo di struttura secondaria delle proteine è noto come struttura a foglietto ripiegato.
Studia con noi