Elettrolisi dell'acqua
Relazione di laboratorio: elettrolisi dell'acqua
Introduzione
L'elettrolisi è un processo che utilizza energia elettrica per fare avvenire reazioni redox altrimenti non spontanee.
Queste reazioni sono dovute a fenomeni di riduzione e di ossidazione che si hanno quando gli ioni in soluzione vengono a contatto con gli elettrodi di un generatore di corrente continua.
Non è possibile effettuare l'elettrolisi dell'acqua distillata perché essa è troppo poco dissociata in ioni H3O+ e OH− per permettere un apprezzabile passaggio di corrente.
Per ottenere l'elettrolisi dell'acqua è pertanto indispensabile aggiungere piccole quantità di solfato di sodio Na2SO4 (o di acido solforico H2SO4) allo scopo di renderla conduttrice.
Scopo dell'esperienza
Effettuare l'elettrolisi dell'acqua ed osservare le reazioni provocate dal passaggio della corrente elettrica nella soluzione.
Attrezzature
Generatore di corrente elettrica continua
Sostegno metallico
Due pinze porta-provette
Elettrodi di grafite
Fili elettrici
Morsetti a coccodrillo
Becher da 200 mL
2 provette di vetro
Materiali e reagenti
Soluzione diluita di solfato di sodio Na2SO4
Procedimento
Con una soluzione di solfato di sodio diluita si riempie per ¾ un becher da 200 mL.
Si riempione due provette con la soluzione di solfato di sodio e le si immergono rovesciate nella soluzione contenuta nel becher facendo attenzione che la soluzione riempia completamente le provette.
Servendosi delle apposite pinze si fissano saldamente le due provette al sostegno metallico.
Si inseriscono all'interno di ciascuna provetta i due elettrodi di grafite collegati tramite cavi elettrici al generatore di corrente.
Si accende il generatore di corrente; si nota la formazione di bollicine ad entrambi gli elettrodi.
Con il procedere dell'elettrolisi si nota che all'interno delle due provette vengono raccolti dei gas.
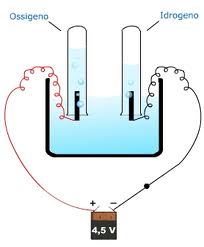
All'elettrodo positivo avviene la seguente reazione:
2 H2O(l) → 4 H+(aq) + O2(g) + 4 e−
e si ha quindi l'accumulo di ossigeno.
All'elettrodo negativo avviene la seguente reazione:
2 H2O(l) + 2 e- → 2 OH-(aq) + H2(g)
e si ha quindi l'accumulo di idrogeno.
La reazione complessiva è la seguente:
2 H2O(l) → 2 H2(g) + O2(g)
Si osserva inoltre che il volume di idrogeno raccolto è doppio rispetto a quello dell'ossigeno.
Si solleva lentamente la provetta contenente ossigeno e si nota che avvicinando un fiammifero acceso all'imboccatura della provetta la fiamma si ravviva; questo conferma che il gas prodotto è ossigeno.
Si solleva lentamente la provetta contenente idrogeno e si nota che avvicinando un fiammifero acceso all'imboccatura della provetta si ha una piccola detonazione dovuta alla reazione esplosiva tra l'idrogeno prodotto dal processi di elettrolisi e l'ossigeno presente nell'aria; questo conferma che il gas prodotto è idrogeno.
Studia con noi