Costruzione di una pila Daniell
Relazione di laboratorio: come costruirsi una pila Daniell
Introduzione
La pila è un dispositivo che trasforma l'energia chimica in energia elettrica. Un tipico esempio di pila, è la pila Daniell costituita da due elettrodi di rame e zinco immersi in due soluzioni dei loro sali e collegate da un ponte salino.
Attrezzature
2 becher da 100 mL
Tubo di vetro ad U
Morsetti a coccodrillo
Portalampadina con lampadina da 6 V
Filo elettrico
Cotone idrofilo
Voltmetro
Carta vetrata
Materiali e reagenti
Lamina di zinco
Lamina di rame
Soluzione satura di solfato di sodio Na2SO4
Soluzione 1 M di solfato rameico CuSO4
Soluzione 1 M di solfato di zinco ZnSO4
Procedimento
Si versano in due becher da 100 mL le soluzioni rispettivamente di solfato rameico CuSO4 e di solfato di zinco ZnSO4.
Si puliscono le due lamine metalliche di zinco e di rame grattandole con della carta vetrata.
Si immerge la lamina di zinco nella soluzione di solfato di zinco e la lamina di rame nella soluzione di solfato rameico.
Si riempie il tubo ad U con la soluzione satura di solfato di sodio chiudendo le due estremità del tubo con due batuffoli di cotone idrofilo.
Le due estremità del tubo ad U vengono immerse nelle due soluzioni.
Si collegano le lamine di zinco e di rame ai poli del portalampadina (o del tester).
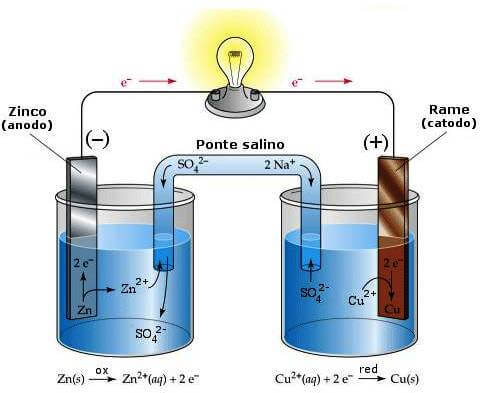
Pila Daniell
All'anodo (rappresentato nel becher di sinistra) lo zinco metallico si ossida e passa in soluzione come ione Zn2+; la soluzione di solfato di zinco tende quindi ad arricchirsi di ioni Zn2+. La semireazione è la seguente:
Zn → Zn2+ + 2e−
Al catodo gli ioni Cu2+ si riducono a rame metallico; la soluzione tende quindi ad impoverirsi di ioni Cu2+. La semireazione è la seguente:
Cu2+ + 2e− → Cu
Complessivamente l'anodo tende a caricarsi positivamente mentre il catodo tende a caricarsi negativamente. Per garantire l'elettroneutralità delle due soluzioni è quindi necessario collegarle attraverso il ponte salino che fornisce ioni Na+ alla soluzione catodica e ioni SO42− alla soluzione anodica.
La pila così costituita può essere schematizzata nel seguente modo:
(-) Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s) (+)
La doppia barra // indica il ponte salino.
La reazione complessiva che avviene è la seguente:
Zn + Cu2+ → Zn2+ + Cu
Staccando il circuito esterno e collegando le due lamine con un voltmetro, si nota che la pila fornisce una d.d.p. di 1,1 V.
Studia con noi