Spettro di assorbimento
Spiegazione degli spettri di assorbimento
In questa lezione studieremo che cosa sono gli spettri di assorbimento e a cosa sono dovuti; vedremo in particolare gli spettri di assorbimento di due sostanze comuni: il sodio e l'idrogeno. Studieremo infine quale relazione esiste tra lo spettro di assorbimento e lo spettro di emissione di una sostanza. Termineremo la lezione con un breve riassunto che aiuterà a focalizzare al meglio i concetti espressi.
Come si ottiene uno spettro di assorbimento?
Quando la luce bianca attraversa un gas o un vapore, allo spettro continuo vengono a mancare alcune radiazioni monocromatiche, le quali sono state assorbite dal gas o dal vapore.
Infatti facendo passare questa luce attraverso un prisma ottico di vetro trasparente, si nota che nello spettro sono presenti una o più righe nere su uno sfondo colorato continuo. Lo spettro corrispondente si chiama spettro di assorbimento.
A ciascuna riga è associata una transizione quantica di un elettrone da un livello elettronico di energia inferiore a un livello elettronico di energia superiore; ogni transizione è a sua volta associata all'assorbimento di radiazione elettromagnetica di frequenza corrispondente alla differenza di energia tra i due livelli interessati alla transizione.
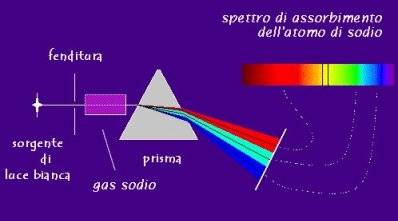
Come si registra lo spettro di assorbimento dell'atomo di sodio.
Confrontando lo spettro di emissione e quello di assorbimento di una stessa sostanza, si nota che le righe nere nello spettro di assorbimento cadono nella stessa posizione (frequenza) delle righe colorate dello spettro di emissione.
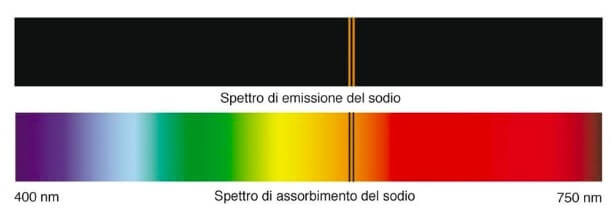
Spettro di emissione (in alto) e spettro di assorbimento (in basso) dell'atomo di sodio. (Le lunghezze d'onda sull'asse delle ascisse sono espresse in nm).
Se ne conclude che tutte le sostanze assorbono radiazioni luminose della stessa frequenza e lunghezza d'onda di quelle che sono in grado di emettere. Nella figura precedente è possibile notare la differenza tra lo spettro di emissione e lo spettro di assorbimento dell'atomo di sodio.
Allo stesso modo del sodio, se idrogeno rarefatto viene interposto tra la sorgente e il prisma, quello che si ottiene è lo spettro di assorbimento dell'atomo di idrogeno. Questo spettro si presenta come uno sfondo colorato continuo separato da alcune righe nere dette "di assorbimento".
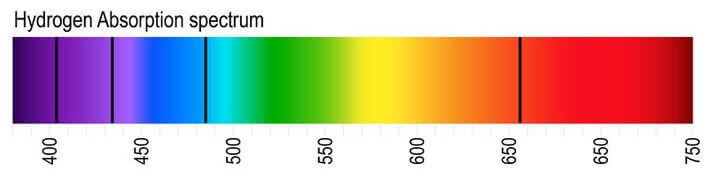
Spettro di assorbimento dell'atomo di idrogeno (le lunghezze d'onda sull'asse delle ascisse sono espresse in nm).
Anche in questo caso è possibile vedere che le righe nere nello spettro di assorbimento coincidono con le righe colorate dello spettro di emissione. Quindi tutte le sostanze assorbono radiazioni luminose della stessa lunghezza d'onda e frequenza di quelle che sono in grado di emettere.
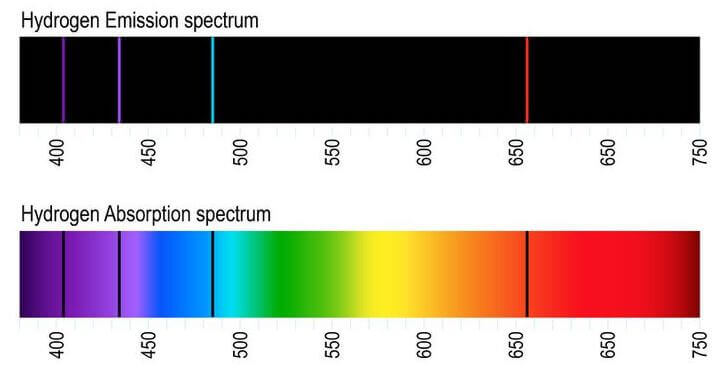
Spettro di emissione (in alto) e spettro di assorbimento (in basso) dell'atomo di idrogeno.
Uno spettro di assorbimento (così come uno spettro di emissione) è caratterizzato dalla frequenza v o dalla lunghezza d'onda λ di ogni riga spettrale (si ricordi che c = λ · v, dove c è la velocità delle radiazioni elettromagnetiche nel vuoto), dalle intensità assolute o relative delle righe, dalla loro larghezza e dalla forma in frequenza.
Riassumendo
Si ha uno spettro d'assorbimento quando si interpone sul cammino dei raggi luminosi prodotti da una sorgente che emetta uno spettro continuo una sostanza che assorbe la radiazione che l'attraversa in corrispondenza di certe regioni più o meno estese dello spettro; le radiazioni assorbite dalla sostanza interposta sono esattamente quelle che la sostanza stessa emette quando viene eccitata.
Questa reciprocità tra assorbimento ed emissione costituisce l'essenza della legge di Kirchhoff; essa spiega ad esempio l'origine delle righe nere che si notano nello spettro continuo del Sole (righe di Fraunhofer) attribuendole all'assorbimento da parte dei gas superficiali.
Occorre sottolineare che gli spettri di assorbimento (così come quelli di emissione) sono caratteristici delle sostanze che li producono: ciò è dovuto ai legami tra la struttura della materia e la formazione degli spettri, e permette di determinare la natura di una sostanza mediante il suo spettro e viceversa.
Link correlati:
Qual è la differenza tra uno spettro continuo e uno spettro a righe?
Studia con noi