Solidi metallici
Struttura dei solidi metallici
Un corpo allo stato solido è un materiale che ha forma propria, è incomprimibile, rigido e presenta un proprio volume.
Le particelle che costituiscono il reticolo cristallino di un solido sono animate da un moto oscillatorio (e può esistere anche un moto rotatorio) attorno ad un punto (nodo reticolare) che viene assunto come rappresentativo della posizione (media) della particella nel reticolo cristallino.
In un solido metallico i nodi reticolari sono occupati da ioni del metallo stesso, tenuti assieme da elettroni comuni, di valenza (elettroni di valenza), distribuiti su un grandissimo numero di orbitali metallici che costituiscono i legami fra gli atomi del metallo (legame metallico).
Caratteristiche dei solidi metallici
I solidi metallici sono buoni conduttori in quanto gli elettroni sono liberi di muoversi all'interno del reticolo cristallino.
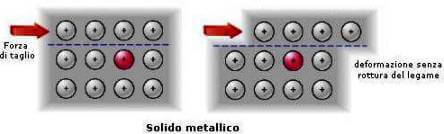
I solidi metallici sono inoltre duttili, cioè possono essere trasformati in fili sottili e sono malleabili (cioè possono essere ridotti in lamine).
Ciò è dovuto al fatto che gli elettroni mobili permettono agli ioni positivi del metallo di "scivolare" gli uni sugli altri, senza compromettere la compattezza della struttura.
L'energia del legame metallico varia notevolmente per i vari metalli (da 60 kJ/mol per il mercurio a 840 kJ/mol per il tungsteno), e di conseguenza i metalli presentano una vasta gamma di temperature di fusione.
Link correlati:
Come possono essere classificati i solidi in base al tipo di legame chimico?
Studia con noi