Pila a secco
Pila a secco: principio di funzionamento
Vuoi sapere che cosa sono le pile a secco?
Vuoi conoscere come funzionano le pile a secco?
Se si continua con la lettura dell'articolo. In questa pagina del sito vedremo infatti che cosa sono le pile a secco, come funzionano, e perché sono così importanti. Vedremo infine quali sono i vantaggi e gli svantaggi di questi tipi di pile.
Le pile a secco sono pile nelle quali le soluzioni ioniche sono "solidificate" opportunamente ricorrendo a materiali adsorbenti che ne rendono più agevole l'impiego; non contendo liquidi hanno il grande vantaggio di essere facilmente trasportabili e utilizzabili.
Esse sono tutte pile irreversibili, ovvero una volta che si sono scaricate non possono essere più rigenerate.
Pila Leclanché
Un esempio classico di pila a secco è la pila Leclanché, ben nota batteria reperibile in commercio, così chiamata in onore del suo inventore, l'ingegnere francese Georges Leclanché (Parmain, 1839 - Parigi, 4 settembre 1882) che la ideò nel 1866.
Essa è formata da due piccoli cilindri concentrici: quello più esterno è costituito dall'involucro di zinco, quello più interno è di materiale poroso (es. cartone); i due cilindri sono separati da una soluzione di NH4+Cl− su gelatina.
L'insieme cilindro di zinco + NH4Cl su gelatina costituisce l'anodo della pila (polo -). Lo scompartimento catodico è invece costituito dal cilindro di cartone riempito con MnO2 mescolato a grafite in polvere.
In questo scompartimento è affondata una bacchetta di grafite che ha il solo compito di condurre elettroni.
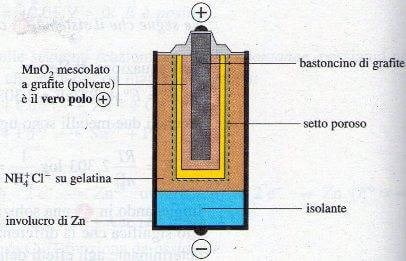
Spaccato di pila Leclanché
La pila Leclanché può essere così schematizzata:
(-) Zn / NH4Cl // MnO2 / C (+)
Reazione all'anodo di una pila a secco
La semireazione redox che si ha all'anodo è la seguente:
Zn → Zn2+ + 2e−
Gli ioni Zn2+ che si formano all'anodo vengono complessati da NH4Cl secondo la reazione:
Zn2+ + 2 NH4Cl → Zn(NH3)2Cl2 + 2 H+
Sommando le ultime due reazioni otteniamo la reazione anodica totale:
anodo (-): Zn + 2 NH4Cl → Zn(NH3)2Cl2 + 2 H+ + 2e−
Reazione al catodo di una pila a secco
Gli elettroni che si formano sulla superficie dello zinco metallico (-), giungono attraverso il circuito esterno sul bastoncino di grafite (+), mentre all'interno della cella gli ioni H+ che si sono formati migrano verso la bacchetta di grafite sulla quale si riducono secondo la reazione:
2 H+ + 2 e− → H2(g)
A causa di questa reazione, la pila tende a fornire una corrente la cui intensità è sempre più debole, in quanto le molecole di idrogeno formano un velo isolante di gas che avvolgendo il bastoncino di grafite, impedisce l'ulteriore scarica degli ioni H+.
Per ovviare a questo inconveniente il bastoncino di grafite viene ricoperto con una pasta di biossido di manganese (MnO2) che impedisce la scarica iniziale degli ioni H+ dato che questi vengono ridotti al catodo secondo la reazione:
catodo (+): 2 MnO2 + 2 H+ + 2e− → 2 MnO(OH)
Reazione globale
Sommando infine la reazione anodica con quella catodica si ottiene la reazione globale della pila Leclanché:
Zn + 2 MnO2 + 2 NH4+Cl− → Zn(NH3)2Cl2 + 2 MnO(OH)
La f.e.m. complessiva della pila è di 1,5 V, ma, come si è detto, durante il funzionamento la f.e.m. tende a ridursi; ciò è dovuto all'accumulo di ammoniaca attorno al catodo in carbonio, e questo costituisce un grosso inconveniente della pila.
Lasciando la pila a riposo o meglio ancora portandola a temperature inferiori a 0°C (a tale scopo è sufficiente metterla in un congelatore), l'ammoniaca tende a formare un complesso con lo ione Zn2+, riattivando - almeno momentaneamente - la f.e.m. originale della pila.
Per evitare questo inconveniente, nelle pile di ultima generazione, il cloruro di ammonio è stato sostituito dall'idrossido di potassio (KOH); le pile così ottenute, note come pile alcaline, riescono a mantenere una tensione elettrica costante durante il funzionamento della pila.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Link correlati:
Che cos'è l'ampere-ora e a cosa corrisponde?
Studia con noi