Legge di Hess
Legge della somma delle entalpie o legge di Hess
La legge di Hess, nota anche come legge della somma delle entalpie, afferma che, per una reazione chimica, ∆H resta invariato sia che la reazione si svolga in un unico stadio sia che si svolga in più stadi.
Considerando la reazione di combustione della grafite, che produce CO2, questa può avvenire secondo due meccanismi diversi:
a) In un unico stadio se la grafite brucia in ambiente ricco di ossigeno:
2 C(s) + 2O2(g) → 2CO2(g) per la quale ∆H = -188,2 kcal
b) In due stadi successivi se l'ambiente è povero di ossigeno. Si forma dapprima CO che a sua volta si combina nuovamente con l'ossigeno per formare CO2:
2 C(s) + O2(g) → 2CO(g) per la quale ∆H = - 52,8 kcal
2 CO(g) + O2(g) → 2CO2(g) per la quale ∆H = - 135,4 kcal
--- che sommate ---
2 C(s) + 2O2(g) → 2CO2(g) per la quale ∆H = -188,2 kcal
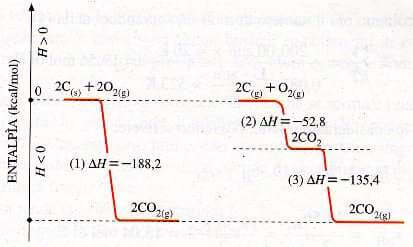
Variazione di entalpia associata alla combustione della grafite.
La legge di Hess permette di calcolare non solo i calori di reazione relativi a fenomeni molto complessi, ma anche calori di reazione difficilmente verificabili in pratica per difficoltà tecniche.
Nell'esempio precedente, solo per le reazioni
2 C(s) + 2O2(g) → 2CO2(g) per la quale ∆H = -188,2 kcal
2 CO(g) + O2(g) → 2CO2(g) per la quale ∆H = - 135,4 kcal
è possibile determinare con certezza il valore del ∆H. Nella reazione
2 C(s) + O2(g) → 2CO(g)
esso si desume per differenza
∆H = -188,2 kcal - (- 135,4 kcal) = - 52,8 kcal
in quanto è assai difficile fermare la combustione della grafite quando questa si è tutta trasformata in CO.
Studia con noi