Configurazione elettronica
Come scrivere la configurazione elettronica di un elemento
Vuoi sapere che cos'è la configurazione elettronica di un elemento?
Vuoi sapere come si scrive la configurazione elettronica e quali regole bisogna seguire per scriverla?
Se si, continua pure con la lettura dell'articolo.
In questa pagina del sito vedremo infatti che cos'è la configurazione elettronica; più in particolare vedremo come è possibile scrivere la configurazione elettronica di un elemento e quali regole bisogna seguire per scriverla.
Infine svolgeremo un esercizio scrivendo la configurazione elettronica di un elemento chimico.
Con il termine configurazione elettronica di un elemento si intende la descrizione della disposizione degli elettroni nei suoi orbitali.
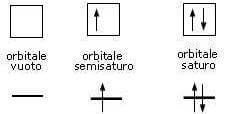
Per descrivere la configurazione elettronica, ogni orbitale viene rappresentato convenzionalmente con un quadratino all'interno del quale vanno inseriti gli elettroni i cui numeri quantici di spin sono rappresentati con frecce verticali rivolte verso l'alto o verso il basso.
A ciascun orbitale viene associata una sigla composta da un numero e da una lettera.
Il numero indica il numero quantico principale, cioè il livello di energia al quale l'orbitale appartiene e può assumere qualsiasi valore intero compreso tra 1 e 7.
La lettera (s, p, d, f) indica il numero quantico secondario e quindi tipo di orbitale. Ad esempio 1s indica l'orbitale sferico (s) presente nel primo livello di energia.
Invece la sigla 2p indica i tre orbitali a doppio lobo (p) presenti nel secondo livello di energia.
Per scrivere la configurazione elettronica di un elemento ci sono tre regole da seguire:
1) Principio della costruzione progressiva (o principio di Aufbau): si occupano prima gli orbitali a più bassa energia e poi quelli a energia più elevata. Il contenuto energetico degli orbitali e quindi la sequenza di riempimento è rappresentata nello schema seguente (ogni orbitale è rappresentato da un quadratino):
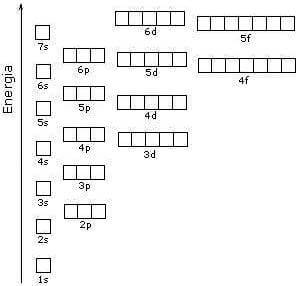
L'ordine di riempimento può essere ricordato seguendo la regola della diagonale:
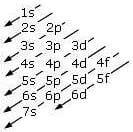
2) Principio di esclusione di Pauli: ogni orbitale può contenere al massimo due elettroni, purché di spin opposto.
In altre parole, all'interno di ogni orbitale (quadratino) possono essere inseriti al massimo due elettroni ma con spin opposto (e quindi verso delle frecce opposto)
3) Regole di Hund: quando si devono riempire gli orbitali aventi la stessa energia (degeneri) si colloca un elettrone su ciascun orbitale e poi si completano gli orbitali semipieni. Se ad esempio, dobbiamo inserire tre elettroni nei tre orbitali degeneri 2p, gli elettroni devono essere collocati nel seguente modo:

Volendo invece inserire per esempio sette elettroni nei cinque orbitali degeneri 4d, dovremo scrivere:

Esempio: configurazione elettronica dell'ossigeno
Partendo dalle regole appena esposte, scrivi la configurazione elettronica dell'ossigeno.
Svolgimento
Applicando le tre regole appena viste, scriviamo, a titolo di esempio, la configurazione elettronica dell'ossigeno, avente numero atomico Z = 8
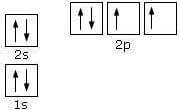
La configurazione elettronica può essere rappresentata in modo sintetico, scrivendo gli elettroni ad esponente della sigla che identifica l'orbitale. Per l'ossigeno avremo:
![]()
nella quale gli esponenti indicano il numero di elettroni che sono collocati in quel tipo di orbitale.
Esercizi sulla configurazione elettronica
Se ti interessano li trovi qui: esercizi sulla configurazione elettronica.
Quiz sull'atomo e sulla configurazione elettronica
Se ti interessano li trovi qui:
Link correlati:
Tavola periodica con configurazione elettronica di tutti gli elementi chimici
Studia con noi