Orbitale di Tipo s
Caratteristiche dell'orbitale s
In ciascuno dei sette livelli di energia è presente un orbitale di tipo sferico (orbitale s), infatti per ciascun livello di energia vi è un orbitale avente numero quantico secondario l = 0 e quindi numero quantico magnetico m = 0.
L'orbitale s ha forma sferica e quindi la probabilità di incontrare gli elettroni che lo descrivono è massima all'interno della sfera.
Gli orbitali dei vari livelli di energia differiscono unicamente per il raggio e per l'energia propria degli elettroni che lo descrivono.
Tali valori crescono al crescere del valore del numero quantico principale n.
Con l'aumentare di n quindi aumenta il raggio dell'orbitale e l'energia degli elettroni.
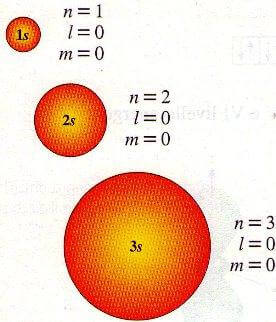
Orbitali 1s, 2s e 3s
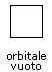
Se l'orbitale sferico è vuoto e quindi privo di elettroni, esso viene rappresentato nel seguente modo:
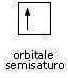
Nel caso in cui l'orbitale di tipo s è parzialmente occupato da un elettrone, esso viene rappresentato nel seguente modo:
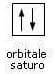
In accordo con il principio di esclusione di Pauli, un orbitale s può ospitare al massimo due elettroni con spin antiparallelo. La rappresentazione è la seguente:
Link correlati:
Qual è la differenza tra orbita e orbitale?
Quanti elettroni possono essere contenuti al massimo in un orbitale
Studia con noi