Spin
Numero quantico di spin dell'elettrone: definizione e spiegazione
In questa lezione vedremo che cos'è il numero quantico di spin; studieremo quali valori può assumere questa grandezza e quali scienziati ne ipotizzarono l'esistenza.
Vedremo infine cosa differenzia il numero quantico di spin dell'elettrone dal suo momento magnetico e cosa afferma il principio di esclusione di Pauli relativamente alla collocazione degli elettroni (con i loro spin associati) negli orbitali atomici.
Si è visto che i primi tre numeri quantici servono a indicare e a distinguere i diversi orbitali atomici; il numero quantico di spin è il quarto numero quantico.
Esso riguarda l'elettrone, viene indicato con la lettera ms e può assumere soltanto due valori: ms = +½ e ms = -½.
Nel novembre del 1925 due fisici olandesi, G.E. Uhlenbeck e S.A. Goudsmit, formularono l'ipotesi che l'elettrone avesse la possibilità di ruotare attorno al proprio asse proprio come fa la Terra.
L'elettrone (come qualsiasi altro sistema materiale) ruotando su se stesso produceva nello spazio circostante un effetto che fu rappresentato con un vettore (si tratta quindi di una grandezza vettoriale) la cui orientazione coincideva con l'asse di rotazione della particella.
Questa grandezza prese il nome di momento angolare di spin dell'elettrone o semplicemente spin dell'elettrone.
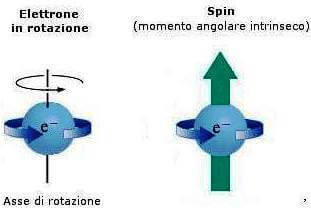
Lo spin dell'elettrone è dovuto al suo momento angolare intrinseco.
Inoltre, poiché l'elettrone possiede anche una carica elettrica, il suo movimento a trottola gli conferiva un'altra proprietà, quella cioè di una minuscola calamita con polo nord e polo sud. Anche questa proprietà dell'elettrone fu rappresentata con un vettore che prese il nome di momento magnetico dell'elettrone.
Per descrivere l'orientazione del vettore di spin dell'elettrone, fu definito quindi un quarto numero quantico che, simboleggiato con ms, prese il nome di numero quantico di spin.
L'elaborazione matematica di Goudsit e Uhlenbeck, portò al risultato che affinché fosse verificata la quantizzazione dell'energia dell'elettrone, erano permessi due valori per il numero quantico di spin: ms = +½ e ms = -½.
Ciò indusse a pensare che per l'elettrone fossero consentiti solo due versi di rotazione su se stesso: l'uno destrorso (da sinistra verso destra) e l'altro sinistrorso (da destra a sinistra) indicati di solito con i termini rispettivamente di "spin su" (↑) e "spin giù" (↓).
La definizione del numero quantico di spin comportò allora che, per definire completamente lo stato di un elettrone di un atomo, era necessario specificare i valori di tutti e quattro i numeri quantici (n, l, m e ms), valori numerici che, una volta assegnati, definivano uno ed uno solo stato stazionario; questo perché due identiche quaterne di valori dei numeri quantici avrebbero descritto lo stato del medesimo elettrone.
Il momento angolare di spin dell'elettrone non va confuso con il momento angolare orbitale, associato al suo movimento attorno al nucleo atomico.
Ipotesi dell'esistenza dello spin
L'esistenza sia dello spin dell'elettrone sia del momento di dipolo magnetico intrinseco a esso associato fu ipotizzata, come detto in precedenza, da G. E. Uhlenbeck e S. Goudsmit nel novembre del 1925 per riuscire a spiegare parecchi fenomeni spettroscopici, tra cui il cosiddetto effetto Zeeman anomalo, l'esistenza di doppietti (coppie di righe assai vicine tra loro) negli spettri degli elementi alcalini e certe particolarità degli spettri ai raggi X.
L'esistenza dello spin dell'elettrone è stata poi confermata da una quantità di fatti e praticamente non vi è teoria relativa a fenomeni elettronici, nucleari, atomici, o molecolari che possa prescindere dallo spin elettronico se si vuole ottenere un buon accordo tra struttura teorica e dati sperimentali.
L'aggiunta dello spin alle proprietà di carica e massa possedute dall'elettrone gli conferisce un moto intrinseco di rotazione su sé stesso.
Spin e principio di esclusione di Pauli
Secondo il principio di esclusione di Pauli in un orbitale possono essere collocati al massimo due elettroni di spin opposto.
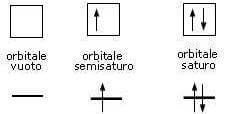
In altre parole, all'interno di ogni orbitale (rappresentato con un quadratino) possono essere inseriti al massimo due elettroni ma che devono avere spin opposto (e quindi verso delle frecce opposto, dove il verso della freccia indica, come detto in precedenza, lo spin dell'elettrone).
Ricordiamo infine che allo spin di un elettrone è associato un momento magnetico noto come momento magnetico dell'elettrone.
Link correlati:
Che cos'è il diamagnetismo?
Che cos'è lo stato quantico?
Studia con noi