Calcoli stechiometrici
Come si eseguono i calcoli stechiometrici
La stechiometria (greco στοιχεῖον "elemento" e μέτρον "misura") è lo studio quantitativo di una reazione chimica.
Tale studio permette di stabilire le quantità di sostanze che, in una reazione chimica, si combinano tra loro per dare i prodotti; altresì permette di determinare, sempre da un punto di vista quantitativo, le masse dei prodotti che si vengono a formare.
In una equazione chimica la stechiometria della reazione viene espressa mediante i coefficienti stechiometrici ovvero opportuni coefficienti che precedono le formule chimiche delle sostanze coinvolte nella reazione; tali coefficienti indicano in quale rapporto in moli reagiscono e si vengono a formare le sostanze.
Così, ad esempio, nella seguente equazione chimica, relativa alla combustione del metano:
![]()
i coefficienti stechiometrici indicano che 1 mole di CH4 reagisce con 2 moli di O2 per formare 1 mole di CO2 e 2 moli di H2O. Nella equazione chimica, per chiarezza, in rosso sono stati indicati i reagenti della reazione (scritti a sinistra della freccia) mentre in verde sono stati indicati i prodotti (scritti a destra della freccia).
Mediante alcuni esempi numerici, vedremo ora come si eseguono i calcoli stechiometrici di alcuni tipici esercizi di stechiometria.
Esempio #1
Stabilire quanti grammi di O2 reagiscono con 1,6 g di CH4 secondo l'equazione:
![]()
Svolgimento dell'esercizio
Come detto in precedenza, l'equazione chimica ci dice che 1 mole di CH4 reagisce con 2 moli di O2 (infatti i coefficienti stechiometrici di CH4 e O2 sono rispettivamente 1 e 2).
Per determinare le moli di O2 che reagiscono bisogna conoscere anzitutto il numero di moli di CH4. Tale dato lo si trova dividendo la massa in grammi di CH4 per il valore della sua massa molare (MM = 16 g/mol):
nCH4 = g / MM = 1,6 / 16 = 0,1 mol
Quindi le moli di CH4 sono 0,1 mol. Per determinare le moli di O2 che reagiscono con 0,1 mol di CH4 dobbiamo ricordare che CH4 e O2 reagiscono nel rapporto di 1 : 2 e impostare la seguente proporzione:
1 : 2 = 0,1 : X
Da cui (per info: calcolo del termine incognito):
X = 0,1 ∙ 2 / 1 = 0,2 mol
A questo punto non rimane altro che determinare la massa di O2 reagita moltiplicando il numero di moli di O2 per la massa molare di O2 (MM = 32 g/mol):
mO2 = n ∙ MM = 0,2 ∙ 32 = 6,4 g
Esempio #2 con reagente in eccesso
Si fanno reagire 6,4 g di SO2 con 4,8 g di O2 secondo la reazione:
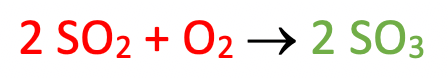
Determinare quanti grammi del reagente in eccesso rimangono non reagiti al termine della reazione chimica e quanti grammi di SO3 si formano.
Svolgimento dell'esercizio
Calcoliamo le moli di SO2 (MM = 64,0 g/mol) e di O2 (MM = 32,0 g/mol):
nSO2 = g / MM = 6,4 / 64,0 = 0,1 mol
nO2 = g / MM = 4,8 / 32 = 0,15 mol
Per stabilire quale dei due è il reagente limitante si può procedere in questo modo: si dividono il numero di moli di SO2 per il coefficiente stechiometrico di SO2 (che è 2) e successivamente dividere il numero di moli di O2 per il coefficiente stechiometrico di O2 (che è 1); il valore più piccolo è quello del reagente limitante. In base a quanto detto si ha che:
0,1 : 2 = 0,05 mol (SO2)
0,15 : 1 = 0,15 mol (per O2)
Il reagente limitante è quindi SO2. I calcoli appena effettuati servono unicamente a stabilire il reagente limitante.
Al termine della reazione SO2 avrà quindi reagito completamente mentre O2 rimarrà in eccesso. Per stabilire quanti grammi di O2 rimangono in eccesso dobbiamo stabilire anzitutto quanti grammi di O2 reagiscono.
SO2 e O2 reagiscono nel rapporto di 2 : 1. Impostiamo quindi la seguente proporzione:
2 : 1 = 0,1 : X
da cui:
X = 0,05 mol
Quindi reagiscono 0,05 ml di O2 che corrispondono a:
mO2 reagita = n ∙ MM = 0,05 ∙ 32 = 1,6 g
Siccome di O2 ne abbiamo 4,8 grammi di cui 1,6 grammi reagiscono, calcoliamo i grammi di O2 che rimangono in eccesso al termine della reazione:
4,8 - 1,6 = 3,2 g di O2 in eccesso (rimangono non reagiti al termine della reazione).
Rimane da calcolare il numero di grammi di SO3 che vengono prodotti. Per il calcolo si parte dal dato delle moli del reagente limitante. SO2 e SO3 sono nel rapporto di 2 : 2. Impostiamo quindi la seguente proporzione:
2 : 2 = 0,1 : X
Da cui:
X = 0,1 mol di SO3 prodotta
Calcoliamo infine la massa di SO3 (MM = 80,0 g/mol) prodotta:
mSO3 = n ∙ MM = 0,1 ∙ 80 = 8,0 g
Link correlati:
Esercizi online e gratuiti di stechiometria
Esercizi svolti sulla mole
Come si convertono le moli in grammi
Studia con noi