Perossido di sodio
Proprietà e caratteristiche del perossido di sodio
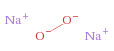
Il perossido di sodio è un composto con formula chimica Na2O2. Si presenta come una polvere bianco-giallognola.
È un potente ossidante.
Preparazione del perossido di sodio
Il perossido di sodio si ottiene scaldando il sodio metallico in una corrente di ossigeno secco.
Dalla reazione si forma inizialmente l'ossido di sodio Na2O che in un secondo momento reagisce con altro ossigeno formando il perossido Na2O2:
4 Na + O2 → 2 Na2O
2 Na2O + O2 → 2 Na2O2
Il perossido di sodio può essere anche ottenuto facendo passare un flusso di gas ozono, O3 (prodotto tramite opportuni ozonizzatori) su ioduro di sodio solido posto all'interno di un tubo di platino o palladio.
L'ozono ossida il sodio portando alla formazione di perossido di sodio. Lo ioduro viene invece liberato sotto forma di iodio elementare in cristalli che sublimano per blando riscaldamento.
Il platino o il palladio del tubo fungono da catalizzatori e non vengono attaccati dal perossido di sodio.
Applicazioni del perossido di sodio
Il perossido di sodio trattato con acqua fornisce acqua ossigenata H2O2 secondo la seguente reazione:
Na2O2 + 2 H2O → 2 NaOH + H2O2
In passato tale reazione è stata utilizzata nel processo di sbianca delle fibre tessili.
Il perossido di sodio viene utilizzato per depurare l'aria viziata dalla respirazione perché assorbe l'anidride carbonica liberando ossigeno:
2 Na2O2 + 2 CO2 → 2 Na2CO3 + O2
Per questo motivo viene utilizzato nei sommergibili.
Assorbe anche l'ossido di carbonio trasformandosi in carbonato di sodio:
Na2O2 + CO → Na2CO3
Attualmente il perossido di sodio viene utilizzato in vari processi per l'estrazione di minerali e in poche altre applicazioni specialistiche.
Struttura del perossido di sodio, Na2O2
Ioni equivalenti:
Na+ , Na+ , O22−
Studia con noi