Nitrato di bario
Proprietà e caratteristiche del nitrato di bario
Il nitrato di bario è una polvere bianca cristallina con densità 3,24 g/cm3, che fonde a 592 °C, si decompone a temperature più elevate secondo la seguente reazione chimica:
2 Ba(NO3)2 → 2 BaO + 4 NO2 + O2
Presenta una solubilità in acqua di 90 g/L essendo tra i nitrati inorganici il meno solubile. Ha un sapore amaro metallico ed è velenoso.
Formula chimica del nitrato di bario
Il nitrato di bario è un sale ternario con formula chimica Ba(NO3)2 e massa molare pari a 261,35 g/mol. Il suo nome IUPAC è invece: di-triossonitrato (IV) di bario.
È un composto ionico formato dallo ione bario (Ba2+) e dallo ione nitrato (NO32−):
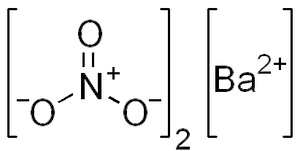
In soluzione acquosa si dissocia pertanto nel seguente modo:
Ba(NO3)2(s) → Ba2+(aq) + 2 NO3−(aq)
Il Ba(NO3)2 deriva quindi formalmente dalla reazione dell'idrossido di bario con l'acido nitrico:
Ba(OH)2 + 2 HNO3 → Ba(NO3)2 + 2 H2O
Preparazione del nitrato di argento
In laboratorio lo si può ottenere trattando con acido nitrico (HNO3) il carbonato di bario (BaCO3), secondo la seguente reazione chimica:
2 HNO3 + BaCO3 → Ba(NO3)2 + H2O + CO2
Alternativamente lo si può ottenere mediante aggiunta di nitrato d'argento (AgNO3) ad una soluzione di cloruro di bario (BaCl2), con conseguente precipitazione del cloruro di argento (AgCl) secondo la reazione:
2 AgNO3 + BaCl2 → 2 AgCl(s) + Ba(NO3)2
Industrialmente lo si ottiene mediante arrostimento della barite con coke, eliminazione del solfuro di bario precipitato per lisciviazione, precipitazione come carbonato mediante l'aggiunta di soda (Na2CO3) e, quindi, dissoluzione in acido nitrico diluito.
Impieghi del nitrato di bario
Il nitrato di bario viene usato per vetrinare la ceramica ma, soprattutto, in pirotecnica; brucia infatti con una fiamma verde pallido.
Trova impiego anche come fonte di ossigeno in polveri infiammabili luminose e nella preparazione delle stelle filanti fatte con polvere di alluminio e limatura di ferro con l'aggiunta di nitrato di bario come fonte di ossigeno (è comunque la limatura di ferro che produce le scintille).
Link correlati:
Proprietà e caratteristiche del nitrato di ammonio
Studia con noi