Carbonato di litio
Proprietà e caratteristiche del carbonato di litio
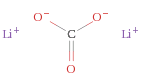
Il carbonato di litio Li2CO3 è il sale ternario che l'acido carbonico forma con il litio. Si presenta come un solido bianco scarsamente solubile in acqua.
A differenza del carbonato di sodio che può esistere sotto forma di tre divesi idrati, il carbonato di litio esiste solo in forma anidra.
Rispetto agli altri composti del litio, il carbonato è scarsamente solubile in acqua; questa caratteristica viene sfruttata per separare da una soluzione acquosa il Li+ sotto forma di carbonato.
L'apparente aumentata solubilità del carbonato di litio in presenza di una leggera pressione di CO2 è dovuta alla formazione del bicarbonato di litio LiHCO3, maggiormente solubile in acqua:
Li2CO3 + CO2 + H2O ⇄ 2 LiHCO3
La solubilità del carbonato di litio diminuisce all'aumentare della temperatura:
- 1,5 g/100 mL (a 0 °C)
- 1,4 g/100 mL (a 10 °C)
- 1,3 g/100 mL (a 25 °C)
- 1,1 g/100 mL (a 40 °C)
- 0,7 g/100 mL (a 100 °C)
Questa particolarità viene sfruttata nel processo di purificazione del carbonato di litio impuro. Infatti, il riscaldamento di una soluzione satura di carbonato di litio porta alla cristallizzazione di Na2CO3 puro.
A differenza di altri carbonati, quello di litio decompone a ossido solo ad alte temperature (> 1300°C):
Li2CO3 → Li2O + CO2
Il carbonato di litio viene prodotto nella reazione tra il perossido di litio Li2O2 e CO2:
2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2
Questa reazione viene sfruttata nelle navicelle spaziali e nei sottomarini poiché viene assorbita dall'ambiente anidride carbonica proveniente dalla respirazione cellulare e viene restituito ossigeno.
Struttura del carbonato di litio, Li2CO3
Ioni equivalenti: Li+ , Li+ , CO32−
Energia di legame C=O: 799 kJ/mol
Energia di legame C―O: 358 kJ/mol
Link correlati:
Proprietà, caratteristiche e formula chimica del carbonato di alluminio
Studia con noi