Esperimento di Franck-Hertz
Spiegazione dell'esperimento di Franck-Hertz
Gli esperimenti e le teorie di inizio secolo del Novecento che portarono alla scoperta della quantizzazione dell'energia (ipotesi di Planck) e alla visione onda-corpuscolo della luce portarono nel 1913 Niels Bohr a stabilire che un atomo può assumere solo certi valori interni di energia e non assume valori di energia qualunque.
L'anno successivo i fisici Franck e Hertz implementarono un esperimento per verificare sperimentalmente quanto teorizzato da Bohr.
L'esperimento consiste nel bombardare con elettroni, caratterizzati da specifici valori di alta energia, atomi di mercurio presenti sotto forma di vapori di mercurio posti in un tubo a bassa pressione e posto tra catodo di emissione di elettroni, una griglia acceleratrice e un anodo posto a una ddp positiva e inferiore rispetto alla griglia.
Lo scopo dell'esperimento è misurare la variazione di energia che gli elettroni subiscono nell'attraversare la sostanza.
Ricordiamo che la massa di un atomo di mercurio è circa mezzo milione di volte più grande di quello dell'elettrone, inoltre la velocità degli atomi di mercurio a temperature di poco superiori a quella ambiente è circa 250 m/s mentre alle energie di 1eV la velocità di un elettrone è di circa 106 m/s per cui per l'elettrone l'atomo di mercurio risulta essenzialmente fermo.
Misurando l'intensità di corrente che scorre nell'anodo in funzione del voltaggio a cui si pone il sistema e quindi dell'energia che si trasmette agli elettroni i due fisici ottennero un grafico non lineare ma che presentava dei picchi:
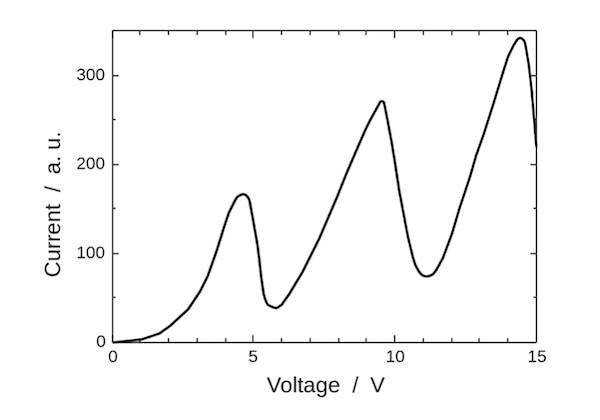
I due fisici notarono in particolare che gli elettroni fino ad energie di 4,0 eV passavano indisturbati attraverso gli atomi di mercurio non cedendo alcuna energia ad essi. Ma dai 5,0 eV in poi notarono che veniva assorbita sempre una stessa quantità di energia pari a 4,9 eV e man mano che aumentava l'energia degli elettroni venivano assorbiti anche altri valori di energia sempre della stessa grandezza 6,7 eV, 8,8 eV. In output si rivelavano infatti due o più categorie di elettroni con diverse velocità e quindi diverse energie.
Schematizziamo questo risultato nella tabella:
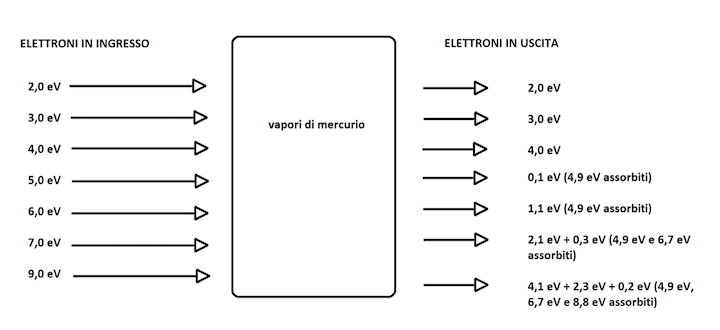
Dal risultato sembrerebbe che gli atomi di mercurio possano solo assorbire valori di energia discreti pari a 4,86 eV, 6,67 eV e 8,84 eV (arrotondati nella tabella sopra).
In effetti la conclusione corretta che si può trarre da questo esperimento è che gli atomi possono assorbire solo valori discreti di energia ovvero solo quanti di energia. Ogni elettrone può occupare solo ben determinati livelli energetici confermando l'ipotesi di Bohr sull'assorbimento di energia da parte degli atomi.
Di norma gli elettroni in un atomo si trovano allo stato fondamentale ovvero ad un livello di energia minimo che come ci insegna la meccanica quantistica non può essere nullo.
Quando viene fornito un livello sufficiente di energia l'elettrone passa ad uno stato eccitato; l'elettrone però non può occupare un livello intermedio tra lo stato fondamentale e quello eccitato e quindi effettua il salto di livello energetico solo quando assorbe una quantità di energia esattamente pari alla differenza di energia tra i due livelli.
Gli elettroni che possedevano un'energia inferiore a 4,86 eV passavano indisturbati attraverso i vapori di mercurio senza perdere la loro energia in quanto il primo stato eccitato si trova a 4,86 eV e quindi la minima energia assorbibile è proprio questa quantità.
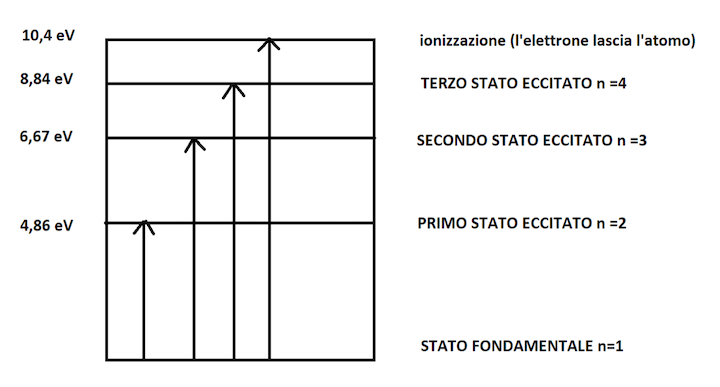
Lo stato fondamentale di un atomo si indica con n=1, il primo stato eccitato con n=2, il secondo stato eccitato con n=3 e così via.
Se un elettrone possiede un'energia di 10,0 eV si potrebbe attivare il salto dallo stato fondamentale al primo, al secondo o al terso stato eccitato con una probabilità diversa per ogni caso.
Nel grafico sopra sono i riportati quindi la differenza di energia tra ogni stato eccitato e l'energia dello stato fondamentale. Quindi ad esempio E2-E1 = 4,86 eV cioè la differenza tra l'energia associata al primo stato eccitato rispetto a quello fondamentale.
Quando l'elettrone si trova nello stato eccitato dopo un breve intervallo di tempo ritorna nello stato fondamentale o a uno stato eccitato più basso e poi a quello fondamentale emettendo un fotone per ogni transizione che avrà la stessa energia pari alla differenza energetica tra i due stati e quindi frequenza a:
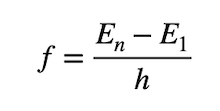
Dalla relazione di Planck per cui l'energia associata ad un quanto di luce è data dal prodotto della costante di Planck (h = 6,626 ∙ 10-34 J∙s) per la sua frequenza.
Franck e Hertz misurarono così la lunghezza d'onda della luce emessa dagli atomi di mercurio eccitati.
Esercizio
Riportiamo nella seguente tabella i valori di lunghezza d'onda della radiazione emessa e misurati in un esperimento di Franck e Hertz attraverso vapori di mercurio dopo averne eccitato gli atomi con elettroni a diverse energia.
Calcolare per ogni lunghezza d'onda l'energia corrispondente del fotone emesso ed individuare sulla base dei livelli energetici sopra esposti quali possono essere il livello di partenza e quello di destinazione finale della transizione energetica.

Lo svolgimento dell'esercizio lo trovi qui: esercizio sull'esperimento di Franck-Hertz.
Link correlati:
Che cosa sono i fermioni?
Che cosa sono i bosoni?
Paradosso del gatto di Schrodinger
Che cos'è la massa relativistica?
Esercizio sul calcolo del fattore relativistico
Studia con noi