Legge di Raoult
Come si determina l'abbassamento della tensione di vapore e la legge di Raoult: formule ed esercizi
Introduciamo inizialmente il concetto di tensione (o pressione) di vapore; definiremo solo successivamente l'abbassamento della tensione di vapore e la legge di Raoult.
Immaginiamo di riempire parzialmente con un liquido, a una certa temperatura, un recipiente chiuso nel quale sia stato fatto precedentemente il vuoto. Inizialmente le particelle tendono ad evaporare, ma dopo un po' di tempo si viene a creare un equilibrio dinamico tra il vapore e il liquido all'interno del recipiente: ciò significa che il numero di particelle che passano dallo stato liquido allo stato di vapore si equivale al numero di particelle che passano dal vapore al liquido.
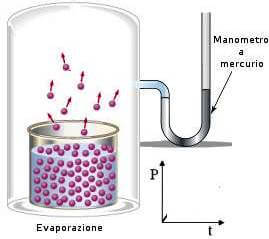
Le particelle evaporate stabiliscono una pressione gassosa al di sopra del liquido che viene chiamata tensione di vapore. La tensione di vapore è pertanto la pressione esercitata dalle molecole che evaporano da un liquido in un recipiente chiuso una volta che la velocità di evaporazione e di condensazione diventano uguali.
Che cos'è l'abbassamento della tensione di vapore?
Se un soluto non volatile viene sciolto in un liquido, ad esempio acqua, diminuisce la tendenza delle molecole dell'acqua (il solvente) ad abbandonare la soluzione e passare allo stato di vapore.
La pressione di vapore della soluzione è quindi più bassa della pressione di vapore dell'acqua pura: una soluzione contenente un soluto non volatile presenta sempre una tensione di vapore più bassa di quella del solvente puro.
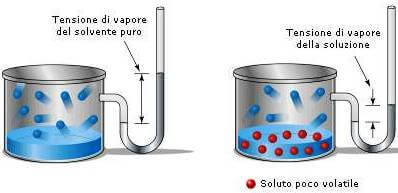
La tensione di vapore della soluzione è inferiore a quella del solvente puro
Legge di Raoult
Il fenomeno descritto è regolato dalla legge di Raoult: la tensione di vapore di una soluzione è direttamente proporzionale alla frazione molare del solvente.
In termini matematici:
![]()
in cui:
- psoluzione = tensione di vapore della soluzione;
- psolvente = tensione di vapore della solvente puro;
- Xsolvente = frazione molare del solvente.
Rappresentando con n il numero di moli, si ha che:
Xsolvente = nsolvente/(nsoluto + nsolvente)
Poiché si tratta di una soluzione si verifica sempre che Xsolvente < 1 e pertanto anche psoluzione < psolvente.
Ricordando che Xsolvente + Xsoluto = 1 e che quindi Xsolvente = 1 - Xsoluto, si ha:
![]()
Legge di Raoult per una soluzione ideale
Prerequisito: nel caso di una miscela binaria, una soluzione si dice ideale se le interazioni che sussistono tra i due solventi A e B sono della stessa entità delle interazioni che si hanno tra molecole dello stesso componente (A con A e B con B); stessa logica esiste tra soluzioni ideali a più di due componenti.
Nel caso di una soluzione ideale ottenuta mescolando due solventi diversi (che chiameremo A e B), la pressione di vapore di questa soluzione ad una temperatura t, è dovuta per una parte (PA) al vapore del liquido A, e per una parte (PB) al vapore del liquido B, ed è:
P = PA + PB
ove PA e PB sono le pressioni parziali di vapore di A e di B.
Raoult dimostrò che per una soluzione ideale di due (o più) liquidi A, B ad una temperatura t, la pressione di vapore dovuta a ciascuno di essi (pressione parziale) è data dal prodotto della pressione di vapore del liquido puro (PA° E PB°) a quella stessa temperatura t, per il valore della sua frazione molare (XA e XB) nella soluzione; cioè:
PA = XA·PA°
e
PB = XB·PB°
Ricordando che:
P = PA + PB
si può scrivere:
P = XA·PA° + XB·PB°
Quest'ultima equazione esprime la legge di Raoult valida per la soluzione ideale di due liquidi A e B. Per soluzioni costituite da n liquidi quest'ultima equazione diventa:
P = ΣiPi = ΣiXi·Pi°
Come già detto, se la soluzione A+B ha comportamento ideale, la pressione di vapore P della soluzione è espressa, ad una temperatura t, dalla relazione:
P = XA·PA° + XB·PB°
Questa equazione mostra che ciascuno dei componenti della soluzione contribuisce alla pressione di vapore P proporzionalmente alla propria pressione di vapore come liquido puro e alla propria frazione molare.
Il diagramma seguente consente di ricavare per via grafica i valori della pressione di vapore P e delle pressioni parziali PA e PB alle varie concentrazioni e alla temperatura t. In tale diagramma sono riportate in ascisse le frazioni molari ed in ordinate le pressioni di vapore; corrispondentemente ad XA =1 (cioè A puro) il segmento NA rappresenta la pressione di vapore di A (PA°) e corrispondentemente a XB =1 (cioè B puro) il segmento MB rappresenta la pressione di vapore di B (PB°).
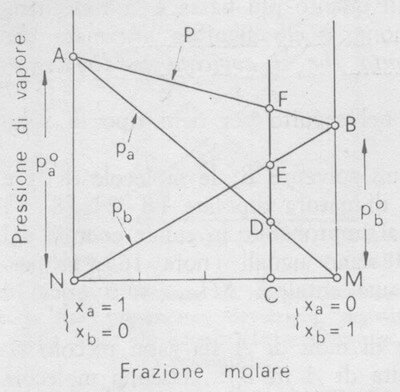
Pressione di vapore di soluzioni ideali di due liquidi (la temperatura è costante).
Il diagramma viene tracciato unendo il punto A con il punto M, il punto B con il punto N, il punto A con il punto B.
Di conseguenza, AM e BN mostrano, rispettivamente, l'andamento di PA e di PB al variare della frazione molare della specie A e della specie B nella soluzione, ed AB l'andamento della pressione di vapore totale (P) della soluzione (A + B) al variare della composizione.
Si consideri ora una soluzione, di concentrazione C (vedi il grafico precedente), della quale si voglia determinare il valore di P ed i valori di PA e di PB. Nella figura:
- CD rappresenta il valore della pressione parziale di A (CD = XA·PA°);
- CE rappresenta il valore della pressione parziale di B (CE = XB·PB°).
Poiché si dimostra geometricamente che CD = EF si ha anche che:
- CF (= CD + CE = XA·PA° + XB·PB°) rappresenta il valore della pressione di vapore totale P.
Pertanto ogni punto del segmento AB rappresenta la pressione di vapore della soluzione la cui concentrazione è data dalla ascissa del punto stesso.
I sistemi (quasi ideali) che seguono con buona approssimazione il grafico precedente sono rari e di norma si hanno deviazioni, dovute alle interazioni fra le molecole dei liquidi che costituiscono la soluzione (reale).
Le deviazioni sono tanto meno sensibili quanto più bassa è la concentrazione di uno dei due componenti della soluzione, e ciò significa affermare che soluzioni molto diluite hanno un comportamento che si avvicina soddisfacentemente al comportamento ideale. Tali deviazioni possono essere negative o positive.
Deviazioni negative dalla legge di Raoult
Le molecole dei liquidi A e B che costituiscono la soluzione interagiscono fra loro (legami dipolari, legami a idrogeno) dando luogo a legami A-B più forti dei legami A- A e B-B esistenti nei liquidi puri.
Diminuisce pertanto, a temperatura costante, il numero delle molecole in grado di evaporare e diminuiscono quindi le pressioni parziali di vapore di ciascuno dei due componenti. Di conseguenza la pressione del vapore in equilibrio con la soluzione (reale) risulta minore di quella calcolabile in base alla legge di Raoult (valida per soluzioni ideali); in pratica il suo valore va determinato sperimentalmente.
Nella figura seguente è mostrato il tipo di diagramma pressione di vapore/composizione della soluzione che si ottiene, ad una certa temperatura, per una generica coppia di liquidi in cui il legame A-B è più forte dei legami A- A e ,B-B.
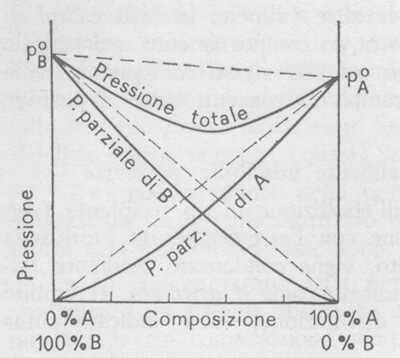
Pressione di vapore di soluzioni che presentano deviazioni negative dalla legge di Raoult (la temperatura è costante).
Deviazioni positive dalla legge di Raoult
Le deviazioni positive dalla legge di Raoult si verificano per lo più quando fra le molecole di A e di B esistono legami più deboli di quelli A-A e B-B esistenti nei liquidi puri A e B. In queste condizioni aumenta la pressione parziale di vapore di ciascun liquido, ed aumenta quindi la pressione di vapore totale.
Nella figura seguente è mostrato il tipo di diagramma pressione di vapore/composizione della soluzione per una coppia di liquidi che presentano deviazione positiva dalla legge di Raoult.
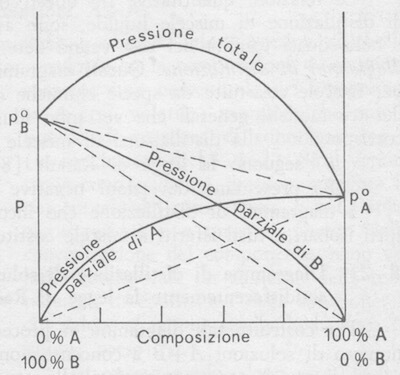
Pressione di vapore di soluzioni che presentano deviazioni positive dalla legge di Raoult (la temperatura è costante).
Esercizio
In 1000 grammi di acqua sono contenuti 100 grammi di glucosio C6H12O6 (Mm = 180 g/mol). Calcolare la tensione di vapore a 28°C di tale soluzione, sapendo che l'acqua pura a 28°C ha una tensione di vapore di 28,35 torr = 28,35 mmHg.
La soluzione dell'esercizio lo trovi qui: pressione di vapore di una soluzione.
Altri esercizi online e commentati sulle proprietà colligative
Li trovi al seguente link: esercizi sulle proprietà colligative.
Studia con noi