Massa atomica e peso atomico
Differenza tra massa atomica e peso atomico
Massa atomica e peso atomico sono concetti fondamentali della chimica; definiscono due grandezze diverse anche se entrambe riferibili alla massa degli atomi.
La massa atomica è la massa di un atomo espressa in grammi (g) o chilogrammi (kg). Le masse atomiche degli atomi sono valori estremamente piccoli: ad esempio, la massa atomica del calcio corrisponde a circa 6,65·10-23 grammi; ciò significa che un singolo atomo di calcio ha una massa di 6,65·10-23 grammi.
È chiaro che non è conveniente, da un punto di vista pratico, usare numeri così piccoli ed è per tale motivo che è stato introdotto il concetto di peso atomico.
Per comprendere il concetto di peso atomico bisogna ricordare che cos'è l'uma (unità di massa atomica), detta anche Dalton.
L'unità di massa atomica corrisponde alla dodicesima parte della massa di un particolare isotopo del carbonio noto come carbonio-12, ed equivale numericamente a 1,66·10-27 kg.
![]()
Il peso atomico (noto anche come massa atomica relativa) è determinato per confronto con l'unità di massa atomica: il peso atomico indica infatti quante volte la massa di un atomo è maggiore (ovvero più "pesante") rispetto all'unità di massa atomica.
Ad esempio, dire che il peso atomico dell'ossigeno è 16 significa affermare che la massa di un atomo di ossigeno è 16 volte l'unità di massa atomica e quindi 16 volte il valore 1,66·10-27 kg.
Il peso atomico essendo una massa relativa dovrebbe essere una grandezza adimensionale (= non dovrebbe avere unità di misura), ma nella comune pratica viene espressa in u cioè in uma (unità di massa atomica).
In altre parole: la massa atomica relativa è una grandezza adimensionale (infatti esprime solo "quante volte la massa di un atomo è maggiore rispetto a un dodicesimo della massa del carbonio-12"), ma normalmente, ed erroneamente, viene espressa in u, cioè uma.
Consultanto qualsiasi tavola periodica, nella quale è solitamente riportato il peso atomico, possiamo quindi affermare che il peso atomico dell'elio è 4,00, mentre il peso atomico del ferro è 55,85.
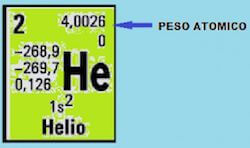
Da peso atomico a massa atomica
Volendo convertire in kg o grammi il peso atomico di un elemento chimico, bisogna ricordare che 1 uma corrisponde a 1,66·10-27 kg. A questo punto è sufficiente impostare una semplice proporzione.
Supponiamo di volere determinare la massa atomica dell'azoto il cui peso atomico è 14,01 u.
Impostiamo la seguente proporzione:
1 uma : 1,66·10-27 kg = 14,01 : X
Da cui:
X = 2,33 ·10-26 kg
Pertanto:
- il peso atomico dell'azoto è 14,01 u;
- la massa atomica dell'azoto è 2,33 ·10-26 kg.
Link correlati:
Tool gratuito e online per il calcolo della massa molecolare
Esercizi svolti e commentati sulla formula minima e molecolare
Tool per il calcolo online del numero di moli
Quanto vale il peso atomico dell'ossigeno?
Studia con noi