Peso atomico
Che cos'è il peso atomico di un atomo?
Vuoi sapere che cos'è il peso atomico di un atomo?
Vuoi conoscere che cosa rappresenta il peso atomico di un atomo, qual è la sua unità di misura e quanto vale?
Se si continua con la lettura dell'articolo.
In questa pagina del sito infatti vedremo che cos'è il peso atomico e quale unità di misura ha.
Affronteremo il calcolo del peso atomico di un elemento chimico conoscendo i pesi atomici degli isotopi che lo costituiscono.
Infine vedremo come è possibile convertire un peso atomico espresso in uma in un peso atomico espresso in grammi.
Che cos'è il peso atomico?
Le masse degli atomi misurate in grammi sono valori molto piccoli. Ad esempio, la massa di un atomo di carbonio-12 è di appena 1,99·10-23 grammi. Non è conveniente, da un punto di vista pratico usare numeri così piccoli.
È più conveniente infatti usare pesi atomici relativi, cioè pesi atomici che sono rapportati ad una grandezza di riferimento, ovvero ad un valore fisso.
Peso atomico relativo
I chimici, hanno introdotto una opportuna grandezza di riferimento che è l'unità di massa atomica (chiamata anche Dalton) che corrisponde alla dodicesima parte della massa di un atomo di carbonio-12 ovvero a 1,66·10-27 kg.
Il peso atomico relativo di un atomo è determinato per confronto con l'unità di massa atomica.
Pertanto: il peso atomico relativo indica quante volte la massa di un atomo è maggiore (ovvero più "pesante") rispetto all'unità di massa atomica.
Da questa quest'ultima definizione è chiaro che il peso atomico relativo è una grandezza adimensionale (infatti esprime solo quante volte la massa di un atomo è maggiore rispetto a una grandezza fissa), ma normalmente, ed erroneamente, viene espressa in u, cioè uma.
Quindi, il valore del peso atomico relativo (detto semplicemente peso atomico) è una grandezza espressa da un numero puro ovvero adimensionale trattandosi di una grandezza relativa.
Esempio pratico
Consultando qualsiasi tavola periodica, in base a quanto detto in precedenza, possiamo affermare che il sodio ha un peso atomico di 23 uma. Ciò significa che un atomo di sodio è 23 volte più pesante dell'uma.
Allo stesso modo, il peso atomico del ferro è 55,85 u, ciò significa che un atomo di ferro è 55,85 volte più pesante dell'uma.
Come posso conoscere il peso atomico di un elemento chimico?
Per conoscere il peso atomico di un elemento chimico devi semplicemente consultare qualsiasi tavola periodica.
Di solito il peso atomico è riportato in alto a destra o in basso al centro della casellina dell'elemento chimico. In ogni caso puoi consultare la leggenda sempre presente in tutte le tavole periodiche.
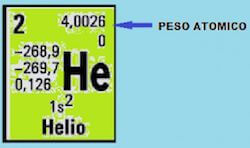
Importante precisazione: nel caso degli elementi bisogna tenere conto che (solitamente) sono costituiti da più isotopi* ciascuno dei quali ha una peso diverso.
* gli isotopi sono atomi dello stesso elemento che hanno lo stesso numero atomico ma un diverso numero di massa; avendo un diverso numero di massa hanno conseguentemente pesi atomici diversi. Il termine isotopo deriva da una parola greca che significa “stesso posto”; gli isotopi di un elemento chimico, infatti, hanno lo stesso numero atomico Z e quindi occupano lo stesso posto nella tavola periodica. Ricordiamoci però che hanno pesi atomici diversi.
In casi come questi (ovvero di elementi chimici costituiti da una miscela di isotopi) il peso atomico dell'elemento chimico è determinato calcolando la media ponderata dei pesi atomici dei vari isotopi che costituiscono l'elemento stesso.
Facciamo un esempio
Calcolo del peso atomico del cloro mediante la media ponderata dei suoi due isotopi
Il cloro (Cl) è costituito da due isotopi:
- il cloro-36 ha un peso atomico di 34,9689 u ed è presente in natura per il 75,77%;
- il cloro-37 ha un peso atomico di 36,9659 u ed è presente in natura per il 24,23%.
Il peso atomico medio del cloro lo si trova dalla media ponderata dei due pesi atomici dei due isotopi. Pertanto:
![]()
Pertanto il peso atomico medio del cloro è 35,45 u, valore che ritroviamo in qualsiasi tavola periodica.
Se un elemento chimico è invece costituita da un unico isotopo (come ad esempio il sodio) allora il peso atomico dell'elemento corrisponderà al peso atomico dell'unico isotopo esistente in natura.
Calcolo del peso atomico in grammi
Se vuoi convertire in grammi il peso atomico di un elemento chimico espresso in uma, devi ricordare che 1 uma corrisponde a 1,66·10-24 g.
A questo punto è sufficiente impostare una semplice proporzione. Supponiamo di volere conoscere a quanti grammi corrisponde il peso atomico dell'elio che vale 4,0026 u.
Impostiamo la proporzione:
1 uma : 1,66·10-24 g = 4,0026 : X
Da cui:
X = 6,644 ·10-24 g
Pertanto il peso di un atomo espresso in grammi è pari a 6,644 ·10-24 g.
Prova tu!
La massa atomica del rame è 63,55 uma. Determina la massa in grammi del rame.
La soluzione dell'esercizio la trovi qui: da uma a grammi.
Link correlati:
Tool gratuito e online per il calcolo della massa molecolare
Differenza tra massa atomica e peso atomico
Esercizi svolti e commentati sulla formula minima e molecolare
Quanto vale il peso atomico dell'ossigeno?
Studia con noi