Carbonio-14
Che cosa è il carbonio-14?
Vuoi sapere che cos'è il carbonio-14?
Sei curioso di sapere perché il carbonio-14 è così importante?
Se si continua pure con la lettura dell'articolo.
Il carbonio-14 (o radiocarbonio) è un isotopo del carbonio.
È un nuclide radioattivo ed è presente solo in tracce avendo una abbondanza isotopica inferiore al 10-12%.
Il suo numero atomico Z è 6 mentre il suo numero di massa A è 14. È quindi formato da:
Protoni e neutroni sono collocati nel nucleo dell'atomo, mentre gli elettroni gravitano attorno al nucleo atomico secondo lo schema semplificato di seguito rappresentato:
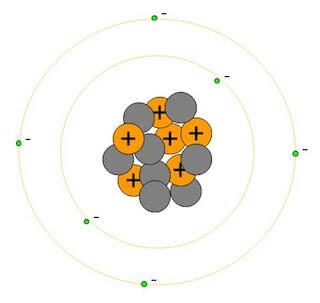
Rappresentazione del carbonio-14.
Inoltre, se per un generico atomo X avente numero atomico Z e numero di massa A, scriveremo:
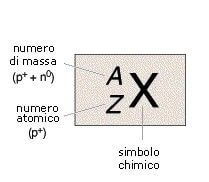
allora per l'atomo di carbonio-14 si avrà:
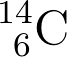
L'importanza del carbonio-14
L'importanza del carbonio-14 risiede nel fatto che tale isotopo, essendo radioattivo, viene impiegato - in campo archeologico - per la datazione dei materiali organici.
Il carbonio-14 viene prodotto continuamente nell'altra atmosfera per azione della componente neutronica dei raggi cosmici secondo la reazione:
14N + n → 14C + p
La 14CO2 - cioè l'anidride carbonica con 14C - così prodotta, si mescola alla CO2 normale del ciclo atmosfera-biosfera-idrosfera.
Il risultato è che il carbonio delle sostanze organiche viventi contiene una quantità fissa e costante di 14C radioattivo corrispondente a 13,56 disintegrazioni al minuto per grammo di carbonio.
Ogni materiale organico vivente conterrà dunque una percentuale fissa e costante di 14C sino a che esisterà uno scambio con l'ambiente circostante, al cessare del quale (morte nel caso di vegetali o animali, isolamento del sistema nel caso di una sostanza inorganica) la quantità di 14C andrà progressivamente diminuendo secondo la legge del decadimento radioattivo.
Misura del contenuto in carbonio-14
Il decadimento del 14C avviene per emissione di elettrone e formazione di 14N secondo la reazione:
14C → 14N + e− + antineutrino + 156,476 keV
È appunto su questo decadimento che sono basati i metodi di misura del 14C.
Si misura cioè, del campione in esame, la quantità di radioattività residua rispetto a quella iniziale e da essa si ricava l'età del campione medesimo.
In altre parole, in seguito alla morte dell'organismo (vegetale o animale) la quantità di 14C si riduce regolarmente, dimezzandosi ogni 5730 anni (emivita del carbonio-14). Nella trattazione dell'argomento bisogna inoltre tenere conto che la decomposizione dei nuclei degli atomi radioattivi (e quindi del 14C) è una tipica reazione del primo ordine.
È quindi sufficiente determinare - tramite un opportuno contatore - la radioattività residua del 14C presente nel campione organico, per stabilire l'età del campione stesso.
L'analisi al carbonio-14 si presta per datare reperti di origine organica con età relativamente breve (non superiore a 60000 anni).
Per reperti ancora più antichi e per le rocce, si ricorre alla determinazione della radioattività di altri isotopi, primo tra tutti il 40K, che ha un tempo di dimezzamento superiore a 1 miliardo di anni.
Esercizio
L'attività del 14C del legno di una tomba egiziana è di 7,26 disintegrazioni al minuto per grammo di campione.
Essendo noto che il periodo di dimezzamento del 14C è di 5730 anni e che 1 g di campione di legno attuale ha un'attività del 14C uguale a 13 disintegrazioni al minuto, calcolare l'età approssimativa del campione.
La soluzione dell'esercizio la trovi qui: analisi al carbonio-14.
Link correlati:
Qual è il numero di massa del carbonio?
Becquerel (unità di misura)
Curie (unità di misura)
Studia con noi