Reazioni del Primo Ordine
Equazione cinetica delle reazioni del primo ordine
La legge cinetica delle reazioni del primo ordine è data dalla seguente relazione matematica:
![]()
da cui risulta che la velocità di reazione è direttamente proporzionale alla concentrazione di un solo reagente anche se la reazione chimica potrebbe coinvolgere più reagenti.
In essa la costante cinetica k viene misurata in s-1.
Integrando la relazione precedente è possibile ottenere l'equazione di velocità integrata:
![]()
nella quale:
- [A]0 indica la concentrazione iniziale del reagente A
- [A]t indica la concentrazione del reagente A al tempo t
- t indica il tempo di reazione
- k indica la costante cinetica
L'importanza di questa equazione è che il rapporto sotto il logaritmo è adimensionale e pertanto il valore numerico di questo rapporto è indipendente dalle unità di misura scelte per esprimere la quantità di sostanza A che può quindi essere espressa indifferentemente in moli, in pressioni parziali, in molarità, in gradi di rotazione della luce polarizzata, ecc.
La relazione precedente può anche essere scritta come:
![]()
dalla quale risulta che, riportando in un sistema di assi cartesiani il ln[A] in funzione del tempo t, si ottiene una retta con pendenza -k:
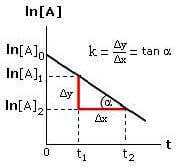
Reazione del primo ordine
La costante cinetica k può essere determinata conoscendo i valori della concentrazione del reagente A in due momenti diversi (t2 e t1).
Dalla relazione:
![]()
si ottiene che il valore della costante k è:
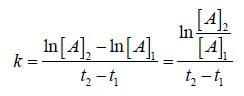
Tempo di dimezzamento in una reazione di primo ordine
Il tempo di dimezzamento in una reazione del primo ordine non dipende dal valore della concentrazione iniziale ma solo dal valore di k. Poniamo infatti:
[A]t = ½ [A]o
Sostituendo questo dato nella:
![]()
si ha che:
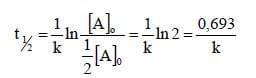
dalla quale si nota che t½ dipende unicamente da k.
Esempi di reazione del primo ordine
I decadimenti radioattivi sono esempi di reazione che seguono una cinetica del primo ordine.
Per esse la costante di velocità specifica k prende il nome di costante di decadimento radioattivo.
Esercizi di cinetica chimica
Li trovi al seguente link: esercizi di cinetica chimica.
Link correlati:
Esercizio svolto sul decadimento dello iodio-131
chimica fisica Atkins (libro)
Studia con noi