Idrolisi del nitrito di sodio
Esercizio sull'idrolisi del nitrito di sodio
35 ml di acido nitroso HNO2 (Ka = 4,5·10-4) 0,05 M vengono fatti reagire con 50 ml di NaOH 0,035 M.
Determinare il pH della soluzione risultante.
Svolgimento dell'esercizio
Determiniamo le moli di acido nitroso HNO2:
nHNO2 = M · V = 0,05 mol/L · 0,035 L = 1,75 · 10-3 mol
Determiniamo le moli di idrossido di sodio NaOH:
nNaOH = M · V = 0,035 mol/L · 0,050 L = 1,75 · 10-3 mol
La reazione chimica che avviene mescolando i due reagenti è la seguente:
NaOH + HNO2 → NaNO2 + H2O
NaOH e HNO2 reagiscono nel rapporto di 1 : 1.
1,75 · 10-3 mol di NaOH reagiscono quindi esattamente con 1,75 · 10-3 mol di HNO2.
Al termine della reazione chimica i due reagenti si sono consumati completamente (nessuno dei due rimane in eccesso).
Le moli di NaNO2 che si ottengono sono 1,75 · 10-3 mol (infatti per ogni mole di NaOH che reagisce si forma una mole di NaNO2).
Determiniamo la molarità di NaNO2 nella soluzione finale dividendo le moli per il volume totale (50 + 35 = 85 mL = 0,085 L):
[NaNO2] = n / V = 1,75 · 10-3 / 0,085 = 0,020 mol/L
NaNO2 si dissocia nel seguente modo:
NaNO2 → Na+ + NO2−
Mentre lo ione Na+ non dà idrolisi (deriva infatti da una base forte, NaOH), lo ione NO2− dà idrolisi basica (deriva infatti da un acido debole):
NO2− + H2O → HNO2 + OH−
Il calcolo della concentrazione degli ioni OH− viene effettuato con la seguente formula:
![]()
in cui:
- Kw = prodotto ionico dell'acqua = 10-14;
- Ka = costante di ionizzazione dell'acido;
- Cs = concentrazione molare dell'anione NO2−.
Pertanto:
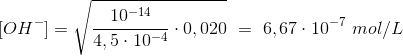
Da cui:
pOH = - log (6,67 · 10-7) = 6,17
e
pH = 14 - 6,17 = 7,83
Studia con noi