Esercizio sulla legge di azione di massa
Esercizio svolto sulla legge di azione di massa
Scrivere l'espressione della costante di equilibrio per la seguente equazione chimica:
2C(s) + O2(g) ⇆ 2CO(g)
Svolgimento dell'esercizio
L'esercizio propone di scrivere l'espressione della costante di equilibrio per una data reazione in fase eterogenea; è necessario infatti notare che mentre O2 e CO sono in fase gassosa, il carbonio (C) è in fase solida.
Per scrivere correttamente l'espressione della costante di equilibrio è necessario ricordare la legge di azione di massa: a una data temperatura, in una reazione chimica all'equilibrio, il rapporto tra il prodotto delle concentrazioni dei prodotti elevate al proprio coefficiente stechiometrico e il prodotto delle concentrazioni dei reagenti elevate al proprio coefficiente stechiometrico, è un valore costante.
L'unico prodotto della reazione chimica è il monossido di carbonio CO (che è in fase gassosa) il cui coefficiente stechiometrico è 2; i reagenti della reazione sono invece l'ossigeno O2 (che è in fase gassosa e il cui coefficiente stechiometrico è 1) e il carbonio C (che è in fase solida e il cui coefficiente stechiometrico è 2).
Pertanto, in base a quanto stabilito dalla legge di azione di massa, al numeratore dell'espressione della costante di equilibrio verrà riportata la concentrazione di CO elevata al quadrato (infatti il suo coefficiente stechiometrico è 2); al denominatore verrà invece riportata la concentrazione dell'ossigeno.
Nell'espressione della costante di equilibrio non deve invece comparire la concentrazione di C in quanto la concentrazione di una specie chimica pura viene convenzionalmente assunta uguale a 1.
Risulta pertanto che l'espressione della costante di equilibrio per l'equazione proposta in precedenza è la seguente:
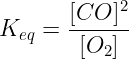
Ricordiamo infine che il valore della costante di equilibrio, per una data reazione chimica, dipende solo ed unicamente dalla temperatura.
Link correlati:
Quiz online sulla costante di equilibrio
Esercizio riguardante l'equilibrio tra NO2 e N2O4
Calcolo delle pressioni parziali di due gas in una reazione all'equilibrio
Studia con noi